
Los telómeros pueden regularse por señales externas a la célula que inducen su multiplicación y que se encuentran implicadas en cáncer, según los datos, que publica PLOS Genetics, de una nueva investigación que profundiza en el papel, acción y actividad de los telóremos en los procesos tumorales y que ha desarrollado el Grupo de Telómeros y Telomerasa del Centro Nacional de Investigaciones Oncológicas (CNIO). Los resultados constituyen un nuevo paso en el desarrollo de más posibilidades terapéuticas centradas en los extremos de los crosomosas que condicionan el envejecimiento celular a medida que se acortan, los telómeros, para el abordaje del cáncer.
Maria A. Blasco, directora del citado grupo y del CNIO, señala a DM que en este trabajo se han generado células humanas modificadas genéticamente “de tal modo que sus telómeros son insensibles a señales externas que inducen la multiplicación celular. Las señales están ahí, pero los telómeros son ‘sordos’ a estas señales”. Estas células, al tener telómeros ‘sordos’ a las señales que inducen la multiplicación celular, son menos capaces de producir cáncer”.
Es la primera vez que consigue este fenómeno, llevado a cabo a través de “la modificación de un solo aminoácido de la proteína telomérica TRF1. Esta modificación en el genoma de las células se ha realizado utilizando la tecnología CRISPR-Cas”.
Sobre si el hallazgo supone otra nueva vía de más fácil acceso a los telómeros y, por tanto, de manipulación más a la carta, la investigadora indica que, en principio, el trabajo “nos dice que se puede controlar la función de los telómeros por factores externos a la célula”.
Pioneros en estas estrategias
El mismo equipo del CNIO también fue pionero en proponer como posible diana contra el cáncer a las shelterinas, proteínas que envuelven a los telómeros y actúan como escudo protector, descubriendo posteriormente que eliminar una de estas shelterinas, TRF1, bloquea el origen y progresión del cáncer de pulmón y glioblastoma en modelos de ratón e impide que las células madre de los glioblastomas formen tumores secundarios.
Han sido también los primeros en encontrar un vínculo inicial entre TRF1 y la ruta de señalización PI3K/AKT. Esta ruta metabólica, que engloba también a mTOR, es una de las más alteradas en numerosos procesos tumorales. Sin embargo, no se sabía si impedir la regulación de TRF1 por esta ruta tendría consecuencias en la longitud de los telómeros y su capacidad para formar tumores. “AKT actúa a modo de transmisor al interior de las células determinadas señales extracelulares provocadas por factores como la presencia de nutrientes, factores de crecimiento o reguladores inmunitarios, entre otros”.
En el nuevo estudio, Raúl Sánchez y Paula Martínez, se plantearon determinar qué importancia tenían los telómeros en esta ruta de señalización para lo cual, modificaron la proteína TRF1 en células para que fuese insensible a AKT, usando la herramienta de edición genética CRISPR/Cas9.
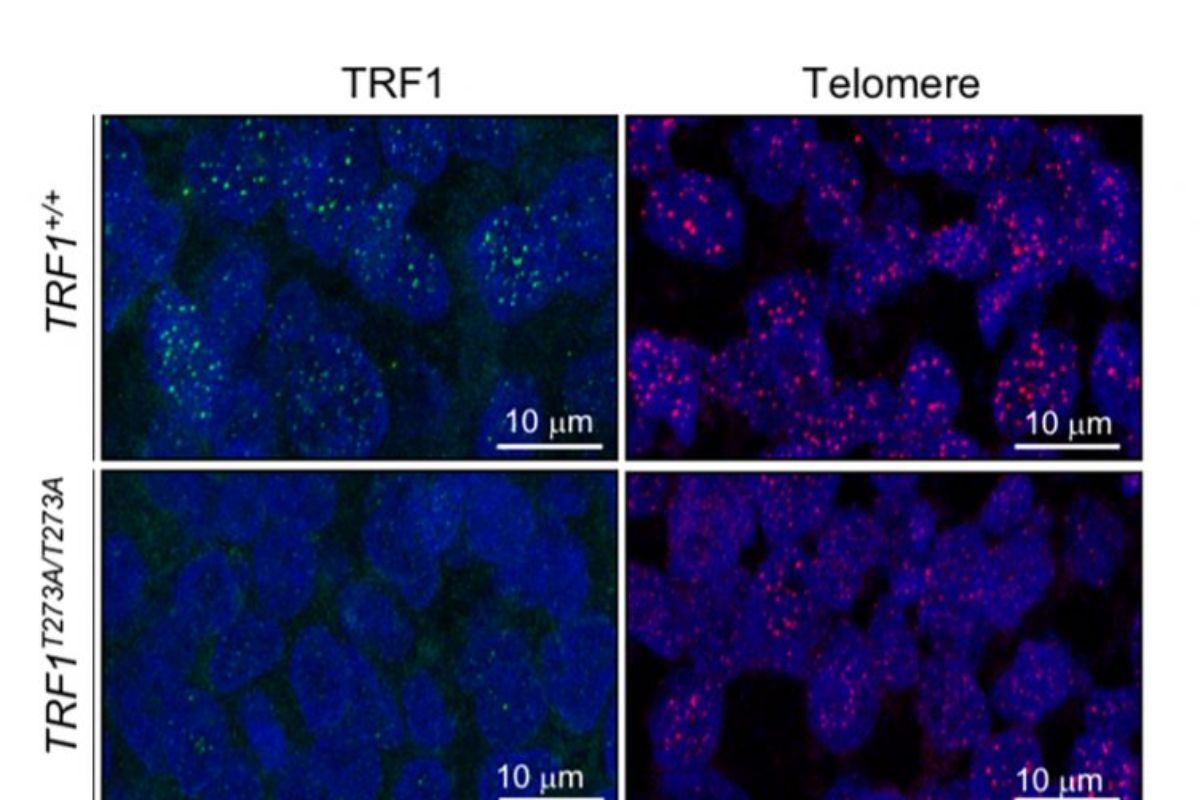
De este modo, TRF1 y los telómeros serían invisibles a estas señales extracelulares transmitidas por AKT. “La consecuencia fue que los telómeros de estas células se acortaron y acumularon más daño y, sobre todo, que las células dejaron de ser capaces de formar tumores, indicando que los telómeros son una de las dianas importantes de AKT y su papel en el cáncer. Pero, lo más importante es que comprobamos que, cuando TRF1 no puede ser fosforilado por AKT, tiene un menor potencial para generar tumores”, explica la directora del CNIO.
Según Blasco, los hallazgos muestran que los telómeros son una de las dianas intracelulares de la ruta de AKT más relevantes para el cáncer, puesto que, aunque no se alteró la función de AKT ni de ninguna de las miles de proteínas que se regulan con ella, solo bloqueando la capacidad de que AKT modifique los telómeros se consiguió frenar el crecimiento tumoral.
Las nuevas posibilidades terapéuticas a las que se alude en la investigación podrían pasar por “el desarrollo de fármacos que bloqueen las señales que recibe la proteína TRF1 -que sería como la ‘antena’ que hay en los telómeros para recibir estas señales- y que serían potenciales antitumorales.
Aunque el ensayo publicado es experimental, una potencial aplicación clínica “podría ser sobre tumores que tengan hiperactivada las rutas que modifican TRF1, consiguiéndose que fuesen más sensibles a la potenciales inhibidores de TRF1 o de la telomerasa”.
Potenciales extrapolaciones
Además, aparte del cáncer, los beneficios podrían extrapolarse a otras patologías, ya que “estos estudios indican que defectos en estas rutas de transmisión de señales a los telómeros también podrían inducir daño en las células e impedir su capacidad de multiplicación. Quizás esto pueda tener relevancia en patologías degenerativas”, señala la investigadora.
Generar ratones modificados genéticamente con telómeros invisibles para AKT es el siguiente paso de las investigaciones con las que los profesionales esperan que sean más resistentes al cáncer.
via Noticias de diariomedico.... https://ift.tt/3f7b10D

No hay comentarios:
Publicar un comentario