.jpg)
Las noticias recientes de que los riñones de cerdo genéticamente modificados sobrevivieron durante más de 2 días después de ser conectados a la circulación de tres humanos con muerte cerebral –dos en la Universidad de Nueva York (NYU) y uno en la Universidad de Alabama de Birmingham (UAB)-, además del trasplante de corazón de cerdo a ser humano que se llevó a cabo el pasado mes de enero en la Universidad de Maryland (UMD), ponen de nuevo sobre el tapete las posibilidades clínicas del xenotrasplante, después de que en la década de 1990 se detuvieran los primeros experimentos en primates no humanos (riñón, hígado y corazón). Tanto Estados Unidos como otros países declararon moratorias por la preocupación de que los retrovirus endógenos del cerdo pudieran causar infecciones contagiosas en humanos, pero los avances en ingeniería genética y en el estudio de los mecanismos inmunológicos estarían abriendo nuevos horizontes para aprovechar órganos porcinos en clínica humana.
Es el posicionamiento de Richard Norris Pierson III, cirujano cardiovascular en el Hospital general de Massachussets (Boston) y director científico del Centro de Ciencias del Trasplante (CTS), donde dirige un laboratorio enfocado a la comprensión y prevención de los mecanismos del rechazo de órganos, al afirmar que las pruebas preclínicas de trasplante de órganos porcinos clonados a primates no humanos predicen su eficacia y seguridad en el uso humano.
Por su parte, Robert Montgomery, responsable del Instituto de Trasplantes Langone de la NY, conocido por ser pionero en cirugía de trasplantes y también como paciente que ha recibido un injerto de corazón, es líder del equipo que ha realizado los dos xenotrasplantes que recoge hoy esta semana el NEJM. Uno de ellos se realizó el pasado septiembre, como comunicó la NYU en octubre a través de una nota de prensa, y el otro se efectuó en noviembre.
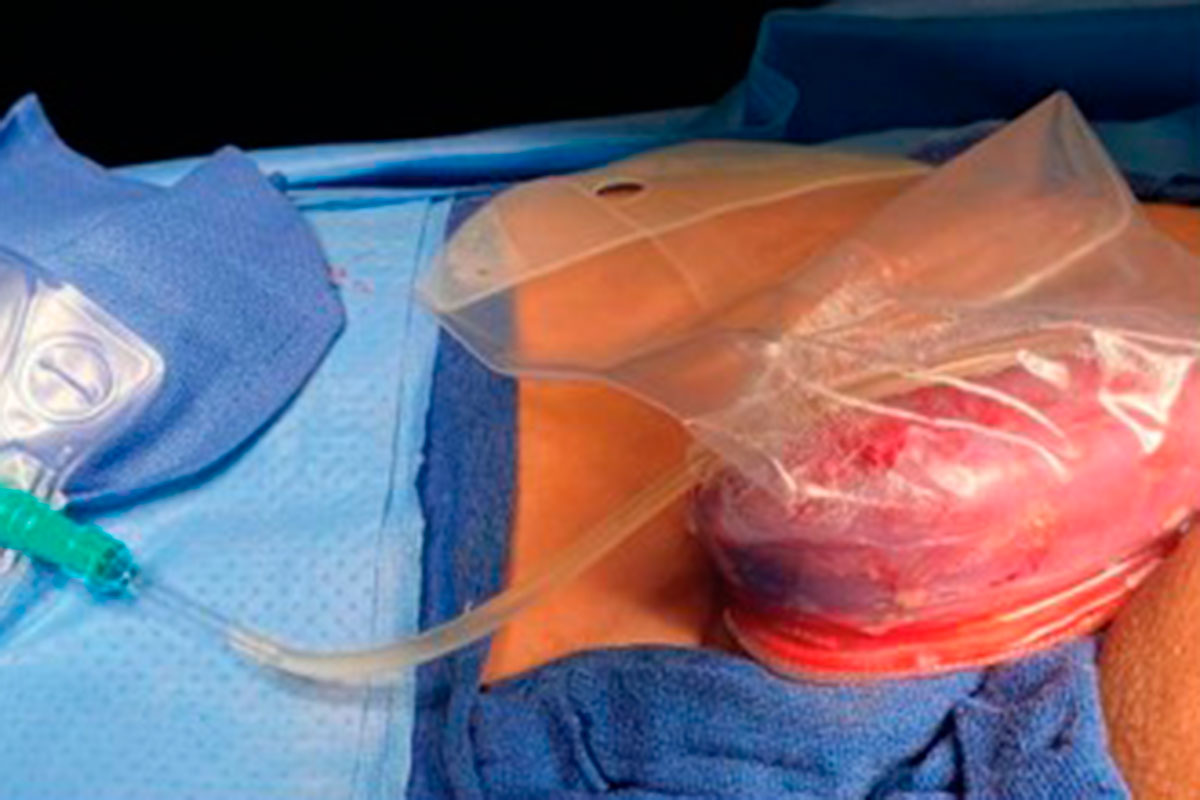
Para evitar el rechazo hiperagudo en ambos casos se utilizaron cerdos criados con un knockout (supresión) del gen de la alfa-1,3-galactosiltransferasa y con tejido tímico autólogo subcapsular del riñón. Los riñones de cerdo modificados se implantaron en receptores humanos con muerte cerebral, manteniendo su actividad circulatoria y respiratoria con ventiladores durante las 54 horas que duró el estudio.
Los resultados más destacados por los investigadores es que ambos injertos comenzaron a producir orina momentos después de la reperfusión, más del doble de la producida por los riñones nativos. Durante las 54 horas la eGFR cinética aumentó considerablemente en los dos receptores y disminuyó el nivel de creatinina. Y los riñones trasplantados mantuvieron todo el tiempo el tono rosado y la perfusión adecuada. Es decir, que xenoinjertos de cerdos genéticamente modificados permanecieron viables y funcionando en receptores humanos con muerte cerebral durante 54 horas, sin signos de rechazo hiperagudo.
Los autores del artículo explican que la clave de los resultados podría estar en la galactosa-alfa-1,3-galactosa (alfa-gal), una modificación de carbohidrato de muchas glicoproteínas y glicolípidos que está presente en la mayoría de las especies. Los seres humanos desarrollan anticuerpos circulantes que la reconocen y pueden provocar un rechazo hiperagudo de los órganos trasplantados que son positivos para alfa-gal. Por ello, creen que “un modelo porcino patentado que incorpore la eliminación de alfa-gal del genoma porcino podría mitigar una importante barrera inmunitaria para el xenotrasplante”.
Pero no sería todo, advierten, porque, aunque la eliminación de alfa-gal del órgano (GTKO en sus siglas en inglés) reduce la respuesta de xenoanticuerpos preformados, la respuesta inmune adaptativa a los xenoinjertos sigue siendo una amenaza: las variaciones de aminoácidos entre cerdos y humanos podrían crear una amplia gama de neoantígenos que el sistema inmunológico humano sería capaz de reconocer. Así el equipo de Montgomery apuesta por el enfoque novedoso de trasplante de un autoinjerto tímico del cerdo debajo de la cápsula del riñón (llamado "timo-riñón") para mitigar el riesgo de activación inmune mediada por células T del huésped. Había evidencia de que esos “timorriñones” pueden promover la tolerancia inmunológica y reducir el riesgo de rechazo tardío del aloinjerto.
La disección de dos modelos
Por su parte, Richard Pierson comenta la investigación de la NYU decantándose por la metodología de la UAB. “Los riñones GTKO podrían no ser óptimos para el trasplante porque expresan, al menos, otros dos antígenos carbohidratos que los anticuerpos anti-cerdo preformados humanos son capaces de reconocer”. Piensa, por tanto, que el riñón de cerdo triple knockout (TKO en sus siglas en inglés) utilizado en la UAB podría ser más útil clínicamente, incluso ofrecer más información sobre la contribución del xenoinjerto a la función renal, ya que en los dos casos experimentales de la NYU los riñones nativos permanecieron en el organismo de los receptores.
“El cerdo utilizado en la UAB no solo se modificó por TKO, sino que también estaba diseñado para enfrentarse a las barreras de vigorosas respuestas inmunitarias innatas y adaptativas, de incompatibilidades entre especies por interacciones moleculares en la coagulación, entre otras, y los riesgos de infecciones oportunistas”, subraya, agregando que la confluencia de anticuerpos humanos anti-cerdo se reduce considerablemente en este tipo de injertos. Sostiene que tanto los receptores de órganos GTKO como TKO suelen presentar una desregulación trombótica dentro del xenoinjerto (microangiopatía trombótica) y en la circulación del receptor (coagulopatía de consumo). Tal desregulación es refractaria a la inmunosupresión intensiva y se observa incluso cuando hay tolerancia inmunológica adaptativa parcial en el compartimento de células T. Pero este “rechazo tardío del xenoinjerto” podría prevenirse mediante la expresión de uno o más genes tromborreguladores humanos, incluidos los que codifican la trombomodulina, el receptor de proteína C de células endoteliales y el CD39 humano.
via Noticias de diariomedico.... https://ift.tt/xcDF9C2

No hay comentarios:
Publicar un comentario