La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) ha actualizado el listado de implantes de relleno utilizados con finalidad plástica, reconstructiva y estética con marcado CE que constan comunicados en el Registro de Comercialización de Productos Sanitarios de la agencia. Dicho listado está disponible en una nueva sección del portal web de la Aemps en la que puede consultarse toda la información al respecto sobre los implantes de relleno con finalidad plástica, reconstructiva y estética.
Desde la agencia explican que los productos que se utilizan como relleno facial o en otras zonas dérmicas y que se aplican mediante inyección, aguja u otro sistema de aplicación, tienen la consideración de producto sanitario siempre que estén destinados por su fabricante a una finalidad médica, como es una finalidad reconstructiva, y que no ejerzan su acción principal en el interior o en la superficie del cuerpo humano por mecanismos farmacológicos, inmunológicos ni metabólicos, pero a cuya función puedan contribuir tales mecanismos.
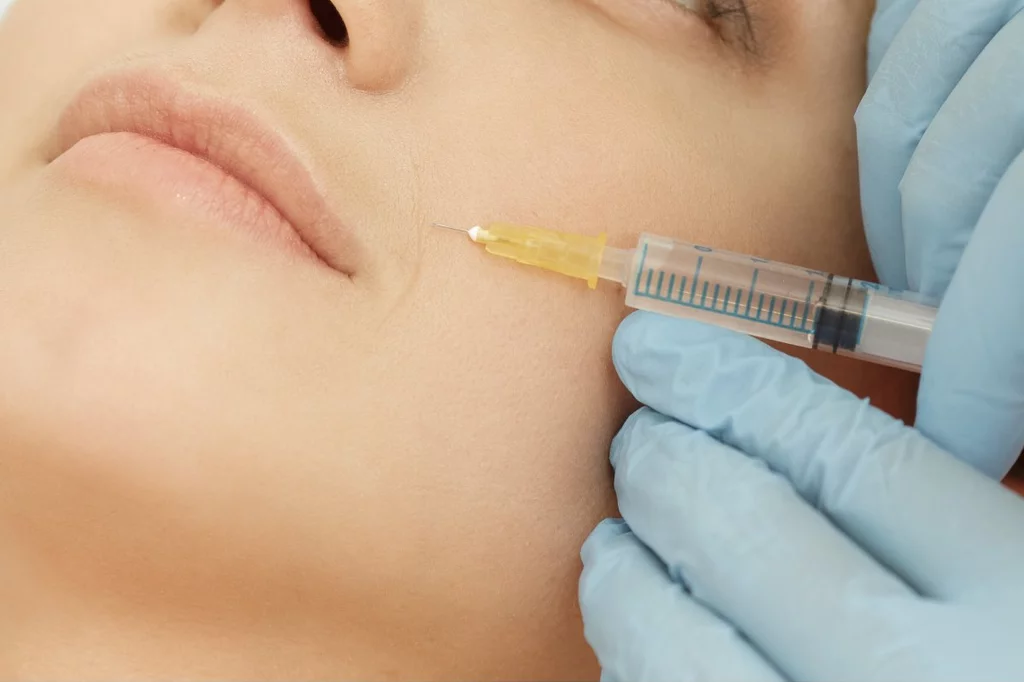
"Sin embargo, los implantes de relleno con una finalidad exclusivamente estética, como puede ser la corrección de arrugas, pliegues o para el aumento de pómulos o labios o realzar distintas zonas corporales, están considerados productos sanitarios sin finalidad médica prevista, incluidos en el Anexo XVI del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo de 5 de abril de 2017 sobre los Productos Sanitarios", añaden desde la Aemps.
Además de los productos citados, también se utilizan con finalidad estética diferentes medicamentos que contienen como principio activo toxina botulínica en una indicación estética. Su utilización debe ajustarse al contenido de su ficha técnica y tener en cuenta la información, precauciones y recomendaciones efectuadas por esta Agencia. "Puede obtenerse la información más actualizada sobre dichos medicamentos en el Centro de Información On line de Medicamentos de la Aemps (CIMA)", explican desde la agencia.
Por otro lado, la Aemps aclara que los productos comercializados como cosméticos, aunque tengan un fin estético y se presenten en viales o ampollas, según lo establecido en su reglamentación, no pueden ser inyectados, al estar esta vía de aplicación excluida de su definición legal: "Inyectar un producto cosmético es un mal uso de los mismos y supone un riesgo para la salud pública. Por esa razón, la Aemps publicó la nota Informativa 1/2020 informado sobre el buen uso de los cosméticos que se presenten en viales o ampollas".
Condiciones para la comercialización
Detalla la agencia que estos productos solo pueden comercializarse si cumplen con las disposiciones establecidas en el Reglamento (UE) 2017/745 y en España con el Real Decreto 192/2023. Esta legislación resultará asimismo aplicable a los productos sin finalidad médica enumerados en el Anexo XVI a partir de la fecha de aplicación de las especificaciones comunes aplicables a estos productos (Reglamento 2022/2346 de la Comisión).
Para ello, tienen que estar provistos de marcado CE, distintivo que declara la conformidad del producto con los requisitos de seguridad y funcionamiento establecidos en la legislación. "El marcado CE debe figurar en el etiquetado y las instrucciones de uso del producto, acompañado de un número de cuatro dígitos que identifica el organismo notificado responsable de los procedimientos de la evaluación de conformidad del producto", subraya la Aemps.
via Noticias de diariomedico.... https://ift.tt/4wgEqsv

No hay comentarios:
Publicar un comentario