El 29 de febrero de 2024 la comunidad española de enfermedades raras tiene más motivos para celebrar su Día Mundial que en los años anteriores, gracias a los datos sobre el acceso a los huérfanos. En 2023 creció de forma sustancial el número de medicamentos para enfermedades raras accesibles a los pacientes españoles. Solo el año pasado se financiaron 21 nuevos huérfanos, 12 más que en 2022, según el último Informe Anual de Acceso de la Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultrahuérfanos (Aelmhu).
Gracias a este incremento, por primera vez en cinco años, España financiaba en 2023 más de la mitad de los medicamentos huérfanos autorizados en la Unión Europea.
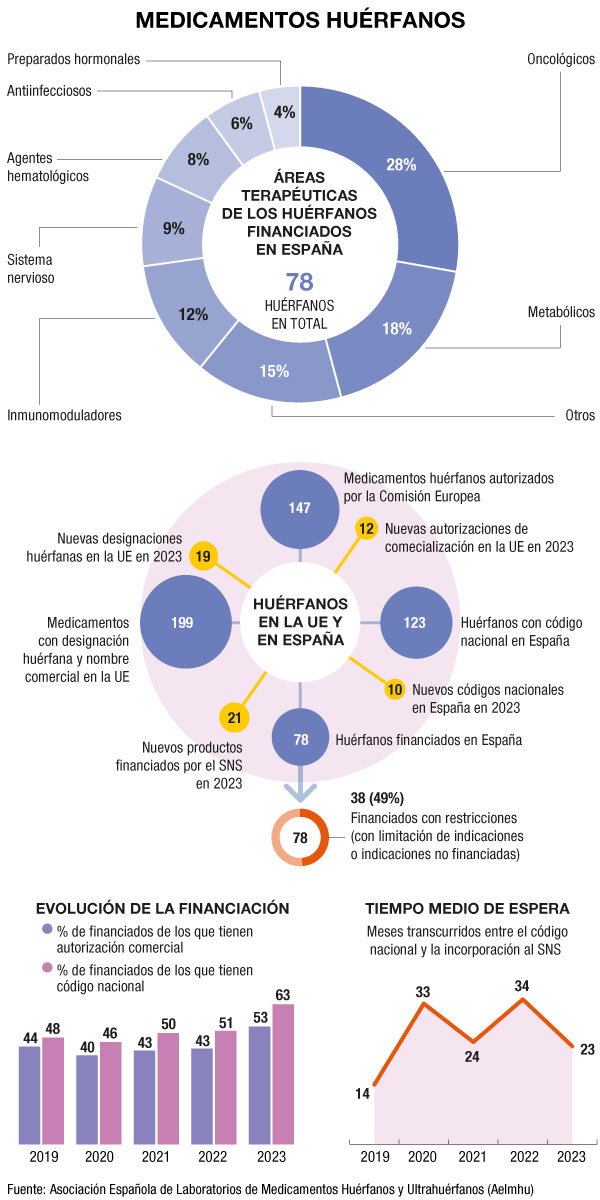
De esta manera, se alcanzaron el año pasado los 78 huérfanos financiados por el Sistema Nacional de Salud, de los 147 que disponen de autorización de comercialización por la Agencia Europea de Medicamentos (EMA). De este total, 24 no tienen código nacional, lo que significa que no han llegado a España.
Tiempos
Otro indicador de la situación del acceso, el tiempo medio para la financiación, también mejoró de forma notable en 2023. La media de tiempo desde la obtención del código nacional hasta el reembolso se situó en 23 meses, 11 menos que en 2022.
La presidenta de Aelmhu y directora general de CSL Behring, María José Sánchez Losada, señala que los datos de 2023 "resultan especialmente positivos" comparados con los de años anteriores, cuando "mostraban una considerable distancia entre los tratamientos que se aprobaban en Europa y su acceso efectivo en España, además de importantes retrasos en los tiempos de financiación".
Comprende que son fruto del "esfuerzo conjunto de todos los integrantes que intervienen en el proceso liderado por el Ministerio de Sanidad". Y remarca que "todos los nuevos fármacos financiados lo han sido mediante acuerdos condicionados, lo que demuestra el compromiso por parte de las empresas farmacéuticas en garantizar la sostenibilidad del Sistema Nacional de Salud".

Aun así, considera prioritaria la reducción de los tiempos de espera para la financiación: "Es cierto que han bajado de los dos años por primera vez desde 2019. Pero seguimos aún lejos de los 14 meses de promedio de 2019, y el 49% de los tratamientos huérfanos que están pendientes de financiación, llevan más de tres años en esa situación".
Una de las reivindicaciones de la patronal es el establecimiento de un modelo de financiación propio para estas terapias: "Deberían incorporarse mecanismos diferenciados acordes con las características específicas de este tipo de productos, para mejorar y agilizar al máximo los procesos de aprobación", sostiene Sánchez Losada.
El otro campo de mejora en el terreno del acceso, observa, sería la unificación de criterios entre las comunidades autónomas: "Además de que podría aportar mejoras operativas y de eficiencia, permitiría garantizar un objetivo que debería ser prioritario para todos: la equidad en el acceso a estas innovaciones", recalca.
Restricciones
Otro de los datos que recoge el informe de la patronal con el balance de 2023 revela que casi la mitad de los 78 medicamentos con reembolso están financiados con restricciones. Además, el 100% obtuvieron un precio condicionado: 5 presentan condiciones de seguimiento, 12 están sometidos a una revisión de ventas y precios, 1 está sometido a coste máximo por paciente y 9 tienen techo de gasto, entre otras condiciones.
También revela que, en el caso los 45 fármacos aprobados en Europa y no financiados en España, la mayoría (40%) se dirigen al tratamiento del cáncer, seguidos por los destinados a enfermedades metabólicas (24%).
Para Sánchez Losada, las dificultades en el acceso tienen que contextualizarse en las particularidades de las enfermedades raras, que suelen asociarse a retrasos diagnósticos y que, en muchos casos apenas tienen opciones de tratamiento. "En muchos de estos casos, la llegada de una nueva opción terapéutica puede suponer la única alternativa para abordar su patología, de ahí que el acceso temprano a estas innovaciones es determinante para la propia evolución de la enfermedad".
Menos aprobaciones en la UE
Por otra parte, las mejoras en los indicadores de acceso en España contrastan con los números europeos en cuanto al descenso en las designaciones de huérfanos y las autorizaciones comerciales. En 2023 se produjeron 19 nuevas designaciones, 10 menos que en 2022, y se aprobaron la mitad de huérfanos: 12 en lugar de 24.
via Noticias de diariomedico.... https://ift.tt/7XzcBtU

No hay comentarios:
Publicar un comentario