El próximo 26 de mayo entrará en vigor el nuevo Reglamento (UE) 2017/745 de Productos Sanitarios, que se desplegará de forma homogénea en todos los países de la UE y que trae cambios que servirán para tener un mayor control de la trazabilidad del producto y para mejorar la seguridad de los pacientes. Viene para sustituir dos directivas todavía vigentes: la de productos sanitarios y la de productos sanitarios de implantes activos, que fueron diseñadas en los años 90 y que se han quedado desfasadas.
Así se ha explicado en un webinar organizado por la Vocalía Nacional de Distribución del Consejo General de Colegios Oficiales de Farmacéuticos y que se celebró ayer jueves. En él han participado Daniel Fernández Font, responsable del Área del Código Nacional de Parafarmacia del Consejo de COF; Carmen Ruiz-Villar, jefe de Departamento de Productos Sanitarios de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), y María Aláez, directora técnica de la Federación Española de Empresas de Tecnología Sanitaria (Fenin).
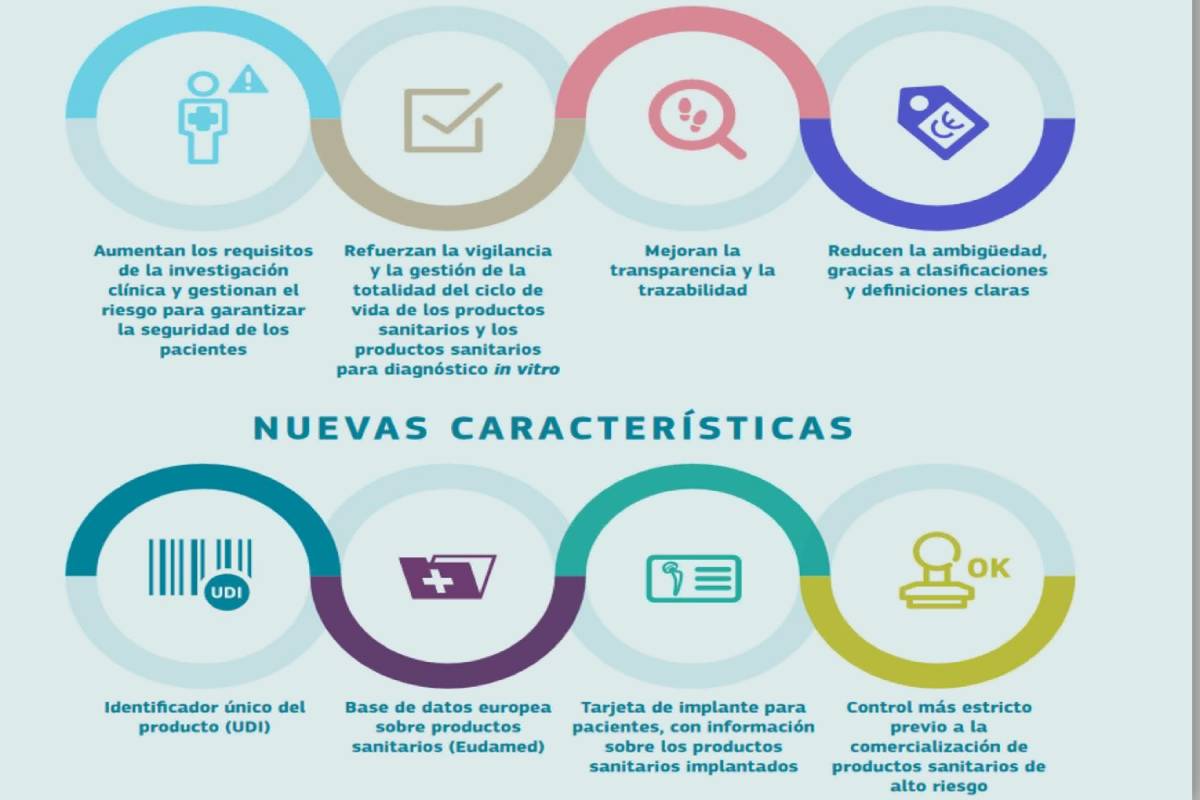
Esta normativa, que se va a ir implantando de forma paulatina hasta mayo de 2025, va a servir para aumentar los requisitos de la investigación clínica y reforzar los estudios poscomercialización para mejorar la vigilancia de los productos sanitarios. Por otra parte, procurará fórmulas para reducir la ambigüedad en el etiquetado gracias a clasificaciones y definiciones más claras. Esto está íntimamente vinculado al identificador único del producto (UDI) y a la base de datos europea sobre productos sanitarios (Eudamed), que aportarán una mayor transparencia en la cadena de fabricación y distribución. “Es verdad que se ha retrasado, pero esperamos poderla tener activa en breve y poder ver en ella todos los productos sanitarios que se comercializan en la UE, incluidos los pacientes, que tendrán acceso a una parte de los contenidos”, comentó la directora técnica de Fenin.
Además, incluye controles más estrictos previos a la comercialización de elementos de alto riesgo, con el fin de evitar problemas como los ocurridos con los implantes mamarios de silicona PIP. “Los fabricantes tienen que cumplir con las obligaciones relacionadas con el sistema de UDI y con el registro. También establecer un sistema de gestión de riesgos y llevar a cabo una evaluación clínica, incluyendo el seguimiento clínico poscomercialización, entre otros aspectos”, apunto Aláez, quien recordó que también han de estar atentos a sus nuevas obligaciones los representantes autorizados, el importador y el distribuidor. Tanto los primeros como los fabricantes será imprescindible esa figura del responsable del cumplimiento de la normativa.
Tarjeta de implante
También traerá consigo la creación de una tarjeta de implante para el paciente implantado, común para todos los países de la UE, en la que aparecerá toda la información relativa a la operación realizada: desde los datos del paciente hasta los del producto implantado, pasando por el centro en el que se ha llevado a cabo la implantación, etc. Ésta seguirá las pautas del nuevo Real Decreto de Productos Sanitarios, todavía en fase de proyecto, diseñado por las autoridades españolas para adaptar el reglamento a las características de nuestro país,
“Debe estar cumplimentada por el centro sanitario y ha de estar en español para garantizar que cualquier paciente pueda comprenderlo”, apunta la responsable de la Aemps. Según la experta, el reglamento da la posibilidad de crear registros nacionales de implantes, muy útiles para obtener información sobre el comportamiento de este tipo de productos en el mercado. “Ahora mismo tenemos los de marcapasos, desfibriladores y prótesis de mamas. En breve saldrá uno de dispositivos de asistencia ventricular izquierda, y estamos trabajando en uno de implantes de rodilla y cadera”, añadió.
El proyecto de real decreto propone, además, la necesidad de contar con licencia para fabricantes (incluidos los que trabajan para terceros y también in-house, es decir, hecho por y para un centro sanitario), importadores y esterilizadores. También para llevar a cabo reprocesamientos, algo que no se ha admitido en todos los países de la UE, aunque sí en España.
“Para la gestión de las licencias hace falta un responsable técnico con titulación universitaria o ciclo formativo de grado superior que acredite cualificación. Y otro responsable del cumplimiento de la normativa. Puede ser la misma persona la que se encargue de ambas, pero tiene que cumplir los requisitos de las dos regulaciones”, indicó Ruiz-Villar.
En cuanto al reprocesamiento, la portavoz de la Aemps comentó que “lo importante es conocer la trazabilidad del producto” y garantizar que su reutilización es segura. “Hay una legislación en desarrollo para los hospitales, donde no se podrá realizar este reprocesamiento a nivel interno hasta que el nuevo reglamento esté operativo, aunque sí podrán encargárselo a organizaciones externas”.
Calendario
El nuevo reglamento europeo se irá aplicando de forma paulatina siguiendo el calendario de transición aprobado por la Comisión Europea. Este calendario ha tenido que retrasarse un año por las dificultades planteadas por la pandemia. “Se creyó que era necesario comenzar en un momento de mayor estabilidad para poder garantizar la disponibilidad de los productos en el mercado”, explicó Font.
Ahora van a tener que convivir durante un tiempo artículos sanitarios que cumplan el reglamento y otros que estén certificados bajo la directiva. “Será a partir de mayo de 2024 cuando todos los productos introducidos en el mercado deberán ser conformes a reglamento, y los que sigan la directiva podrán seguir comercializándose hasta mayo de 2025”, añadió el ponente del Consejo.
Off Gema L. Albendea Política y Normativa Política y Normativa Política y Normativa Off
via Noticias de diariomedico.... https://ift.tt/2RfeXCt


No hay comentarios:
Publicar un comentario