La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) ha publicado su último informe de actividad del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, correspondiente a 2019. Se ha registrado un total de 37.778 casos de sospechas de reacciones adversas a medicamentos (80 casos por 100 000 habitantes), lo que supone un 8% menos que la del año anterior: un 37% de ellos eran graves, y la mayoría estaban relacionados con trastornos gastrointestinales, dermatológicos y del sistema nervioso. El 14% de las notificaciones contenían sospechas de reacciones adversas no conocidas hasta la fecha.
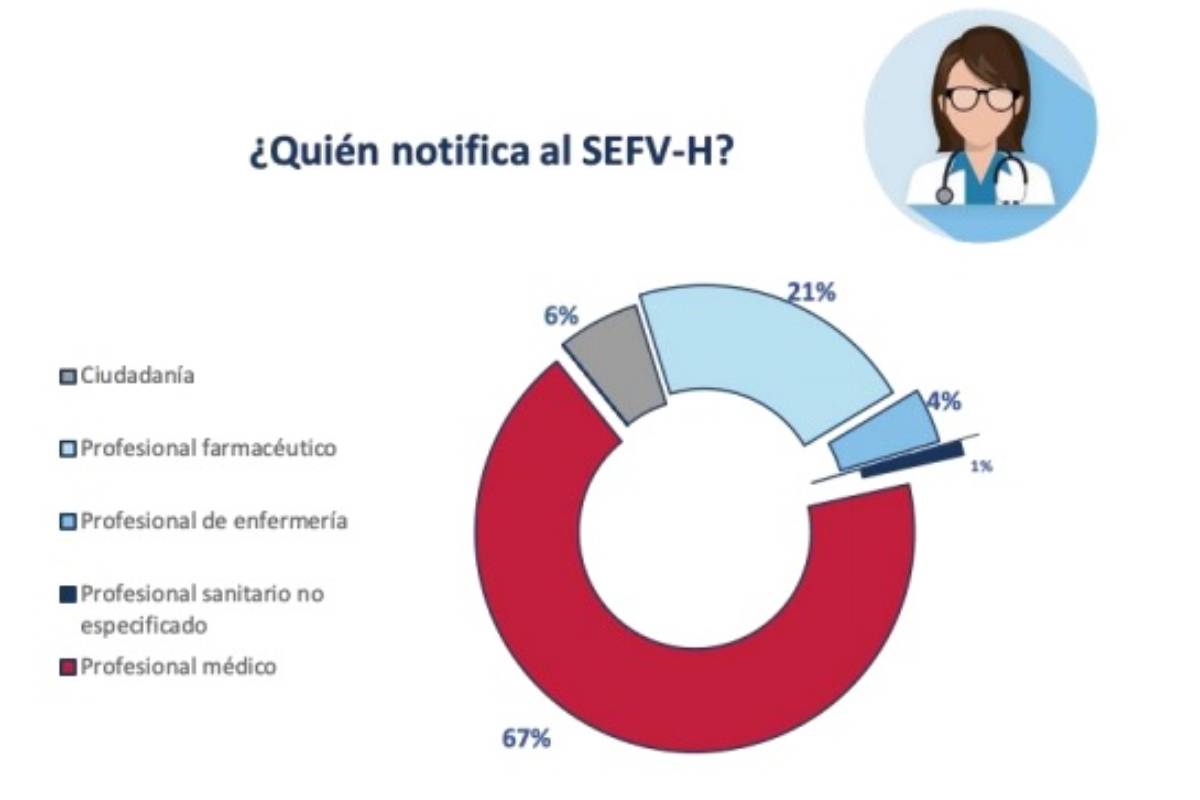
De esos más de 37.000 casos de sospechas de reacciones adversas, un 38% se notificaron a través de los Centros Autonómicos de Farmacovigilancia (SEFVH) y un 62% a través la industria farmacéutica. Esta. En concreto, la mayor parte por profesionales sanitarios, el 67% por profesionales médicos, el 21% por profesionales farmacéuticos y el 4% por enfermeros. Las notificaciones procedentes de la ciudadanía suponen un 6% de los casos.
Notificaciones espontáneas
Del total de los casos notificados a través del SEFV-H, un 88% fueron notificaciones espontáneas. Para los casos notificados a través de la industria farmacéutica este porcentaje fue un 56%. El resto de casos procedían de sistemas de recogida de información organizada, tales como estudios observacionales, programas de seguimiento al paciente o acceso al medicamento a través del uso compasivo. En cuanto a la gravedad, el 46% de los casos recibidos en el SEFV-H y el 54% de los casos comunicados a la industria fueron graves.
Pacientes de casos notificados
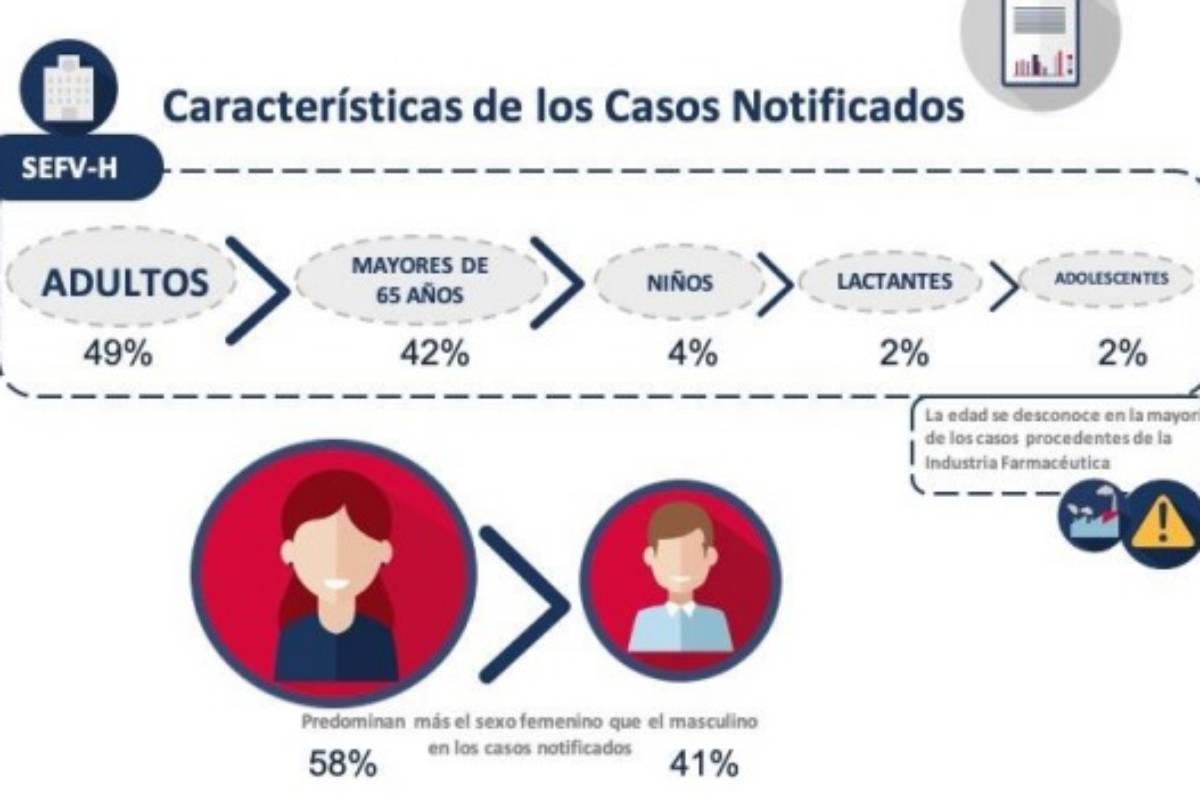
Con respecto a las características demográficas de los pacientes, la mayor parte corresponden a pacientes adultos, seguido de mayores de 65 años, niños, lactantes, adolescentes, recién nacidos y fetos. La edad generalmente está bien documentada, a diferencia de las notificaciones que se reciben a través de la industria farmacéutica. Son más frecuentes las notificaciones que involucran al sexo femenino.
Diferencias según la vía de notificación
El informe de la Aemps señala la dificultad a la hora de recabar datos, tanto por la falta de información como por la no homegeneización de los mismos según la vía de notificación. Para organizar esta información, el organismo indica que existe un formato y unas normas internacionalmente aceptadas. Aun así, subraya que "la falta de información en el contenido de las notificaciones afecta tanto a la detección de posibles duplicados como a la evaluación de cada caso, dificultando, por tanto, la detección de señales".
En este sentido, compara los casos notificados por la industria farmacéutica, que sale peor parada, y los recibidos directamente en el SEFV-H a través de los Centros Autonómicos de Farmacovigilancia.
En qué suspende la industria farmacéutica
La Aemps destaca "la alta calidad de la información en las notificaciones que se reciben directamente en el SEFV-H en todas las variables estudiadas con porcentajes superiores al 80% y en cinco de ellas con valores superiores al 90%". Y lo achaca a varios factores, resumibles en que los técnicos de los centros autonómicos de farmacovigilancia "realizan un trabajo muy concienzudo de recogida de la información esencial. Además, todos los centros trabajan acordes a una guía de codificación que se actualiza anualmente".
¿Dónde flaquea la industria farmacéutica a la hora de notificar casos? En concreto, para las variables demográficas (edad y sexo) se observa que prácticamente la totalidad de los casos que se notifican directamente al SEFVH recogen la edad (98%) y el sexo (99%) del paciente, mientras que los casos que se reciben a través de la industria donde la edad se recoge en el 59% de las notificaciones y el sexo en el 93%.
Respecto a las variables relacionadas con la reacción adversa, se revisó la fecha de inicio de la reacción y el desenlace de la misma. Un 93% de los casos del SEFV-H recogían la fecha de inicio de la reacción, en comparación con los casos de la industria en los que sólo un 37% la recogían. En relación con el desenlace de la reacción, en el 85% de los casos recibidos directamente en el SEFVH constaba esta información comparado con el 56% de los casos procedentes de la industria.
En cuanto a las variables estudiadas de los fármacos sospechosos, la indicación terapéutica es donde menos diferencias se observan entre las dos vías de notificación: en el 82% de las notificaciones del SEFV-H y en el 77% de las notificaciones de la industria.
Las mayores diferencias se observan en la latencia, tiempo que transcurre entre la administración del medicamento y la aparición de la reacción adversa. Se puede conocer o calcular a partir de las fechas de inicio del fármaco y de la aparición de la reacción. Así, en el 94% de las notificaciones recibidas por el SEFV-H se conoce la latencia, dato que baja al 36% en las notificaciones de la industria.
En el campo fecha de inicio del fármaco también se observan notables diferencias: casi la totalidad de las notificaciones del SEFVH contiene la fecha de inicio de fármaco (95%), mientras que en los casos de la industria apenas alcanza la mitad de los casos (48%).
¿A quién hay que notificar y cómo hacerlo?
La Aemps recuerda la importancia de notificar cualquier reacción adversa que se sospeche pueda ser debida a algún medicamento. Estas notificaciones se envían a los centros autonómicos del SEFV-H a través de:
- Los formularios de recogida de la información (tarjeta amarilla) por correo postal.
- El formulario electrónico disponible en https://www.notificaram.es/.
- Cualquier otro medio que pongan a disposición los Centros Autonómicos de Farmacovigilancia1.
Aunque también se puede notificar a través del laboratorio farmacéutico titular de la autorización de comercialización del medicamento sospechoso de haber originado la reacción adversa, la AEMPS trabaja para fomentar la notificación directa al Sistema Español de Farmacovigilancia a través de las tres vías descritas anteriormente.
via Noticias de diariomedico.... https://ift.tt/2WfhPze


No hay comentarios:
Publicar un comentario