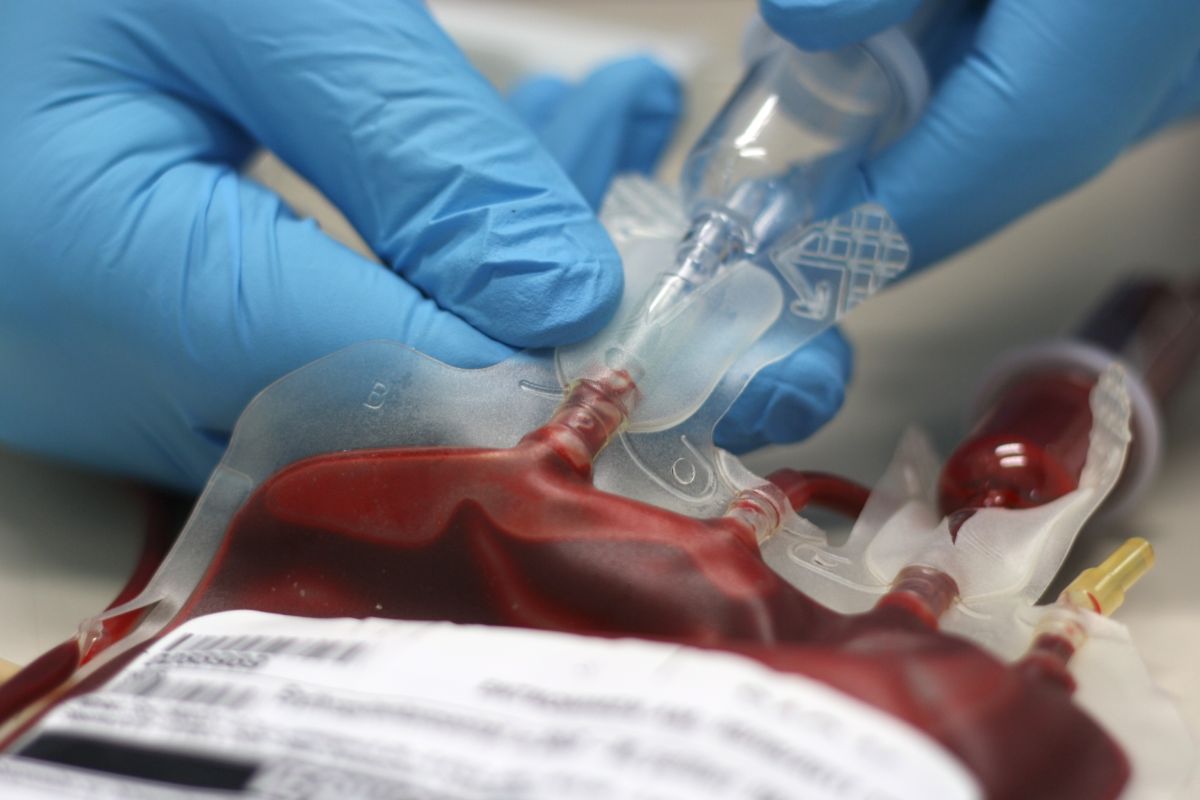
Sin restar polémica a cómo se ha dado un empujón a la aprobación del plasma de curados de Covid como nuevo tratamiento, lo cierto es que supone uno más en el arsenal terapéutico contra el virus en plena pandemia nuevamente al alza. La FDA (Agencia de Regulación del Medicamento de EEUU) ha emitido una autorización de emergencia por el problema de salud pública que supone la infección a nivel mundial (más de 23 millones de contagiados), y por supuesto, a nivel nacional en el país norteamericano (con más de 176.000 muertos).
La administración de Trump ha ayudado en la aceleración del proceso de luz verde. El tratamiento con plasma muestra "una increíble tasa de éxito" y "salvará incontables vidas", clamó Trump el domingo, bastante más exultante que sus propios funcionarios de Salud, que se mostraron mucho más cautos. "A todos nos gustaría que se dieran empujones así", manifiesta Cristina Arbona, vocal de la Sociedad Española de Hematología y Hemoterapia (SEHH) y directora del Centro de Transfusiones de la Comunidad Valenciana, en referencia a la aprobación del plasma hiperinmune: "No tiene malos datos: reduce la tasa de letalidad hasta un 13% en la rama en que se aplica frente al 25% en los que no, según estudios de la Clínica Mayo".
El problema es la falta de homogeneidad en la recogida de los datos, lamenta Arbona: "No se controla como un fármaco, que se administra una dosis en un momento concreto, sino que se da en algunos pacientes antes y en otros después, y no todos los plasmas contienen la misma cantidad de anticuerpos".
Principal ventaja
Se trata de un abordaje terapéutico cuya ventaja principal es que cualquier país puede tener acceso a él, porque se basa en que el plasma de pacientes que han pasado la enfermedad tiene anticuerpos que sirven para neutralizar el virus. Se pegan a él y lo bloquean. «Al bloquearlo, las células del sistema inmunitario tienen más margen para actuar y lo hacen mucho mejor», apunta José Ramos Vivas, miembro del Grupo de Biotecnología de la Universidad de Cantabria y Sociedad Española de Microbiología.
Se cree que el plasma contiene los anticuerpos que pueden ayudar a combatir más rápidamente al Covid-19, y ya ha sido utilizado en pacientes en EEUU y en otros países. Pero los expertos aún discuten su eficacia y algunos advierten de que podría producir efectos secundarios. Ramos explica: "En EEUU sabemos que hay dos estudios muy grandes, uno con 5.000 pacientes y otro con más de 10.000. La tasa de recuperación con un tratamiento temprano está entre el 35% y el 40%. Ayuda mucho cuando se administra de manera precoz en aquellos que todavía no han atravesado la fase más grave, que es cuando se le introduce el respirador. O sea, que cuanto antes se da, mejor funcionar".
La aprobación bajo el epígrafe de emergencia tiene una serie de limitaciones, pero la FDA ha considerado que resulta razonable creer que el plasma convaleciente de pacientes recuperados puede ser eficaz para disminuir la gravedad o acortar la duración de la infección en algunos pacientes hospitalizados. La agencia en este trámite considera que los beneficios conocidos y potenciales del producto, cuando se usa para tratar Covid-19, superan los riesgos conocidos y potenciales, además de que no existen tratamientos alternativos adecuados, aprobados y disponibles.
Europa siempre es más dura a la hora de dar luz verde a nuevos tratamientos, pero "creo que seguirán el ejemplo de EEUU y no va a poner problemas. Si el comité de ética ya ha autorizado estos ensayos, posiblemente no haya muchos problemas para que en Europa se dé el visto bueno", matiza Ramos. En este sentido, la directora del Centro de Transfusiones de la Comunidad Valenciana, subraya que "la UE apuesta por esta terapia, ya acaba de convocar un fondo de ayudas a la investigación para su uso en la pandemia para los próximos nueve meses. Es una buena noticia". Eso sí, Ramos señala que ya hay médicos que están pidiendo un ensayo clínico ciego aleatorio (ECCA) como medida de control del tratamiento: "Sin un ECCA no sé yo si la Agencia Europea de Medicamentos (EMA) lo autorizará", advierte.
Ayuda a otras terapias
En este sentido, "no es la panacea, pero ayuda bastante. Se está pensando para ayudar, sobre todo, a otras terapias. A lo mejor aplicar solo el tratamiento con suero no es efectivo, pero si se administra con otro como antirretroviral, sí que funcionaría bastante bien", cuenta Ramos. A lo que Arbona añade que "se trata de una terapia que suma. No tiene efectos secundarios. En España, ya tenemos diseñada una red para su uso en caso de que fuera necesario".
Así, en el Centro de Transfusiones de Madrid, por ejemplo, ya cuentan en sus reservas con casi 1000 dosis (987 en concreto) de plasma hiperinmune "en previsión de una segunda ola y en previsión de que sea autorizado como tratamiento habitual, más allá del marco de ensayos clínicos y estudios observacionales dentro de los cuales se ha utilizado hasta ahora", explican desde la institución, que en septiembre empieza de nuevo con el programa de extracción y procesamiento de este plasma.
coronavirus Off Pilar Pérez / Alicia Cruz Acal Política y Normativa Política y Normativa Política y Normativa Política y Normativa Política y Normativa Off
via Noticias de diariomedico.... https://ift.tt/2EInxUm


No hay comentarios:
Publicar un comentario