
"En la investigación clínica hay unas probabilidades de transición que son muy difíciles. Por ejemplo, un medicamento que esté en fase I tiene un 52% de probabilidades de pasar a fase II. Es decir, la mitad de los compuestos que están en fase clínica no progresan". Esta es parte de la cruda realidad que Pedro Luis Sánchez García, director del departamento de Estudios de Farmaindustria, expuso en el XVII Seminario Industria Farmacéutica & Medios de Comunicación, organizado por la patronal de la industria innovadora.
Esta probabilidad de transición de fase de las moléculas empeora cuando se trata de pasar de fase II a fase III, que no llega ni al 30% (28,9%). "Es decir, 7 de cada 10 medicamentos que están en fase II no progresan a fase III; ahí mueren", indica Sánchez García.
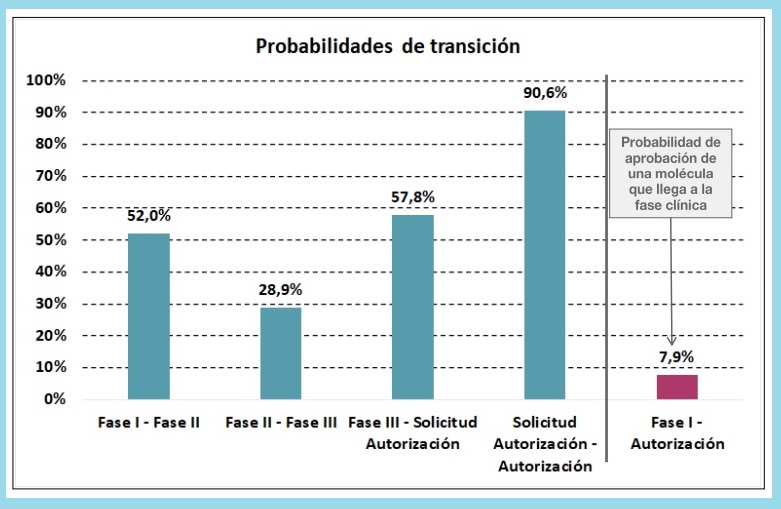
Finalmente, de fase III a solicitud de comercialización "tampoco es para tirar cohetes": es menor del 60% (57,8%). "Y luego, no todo lo que solicita autorización a la Agencia Europea del Medicamento (EMA) y a la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) se aprueba. Evidentemente, el ratio es alto, porque ha pasado muchos filtros, pero es del 90,6%".
Vistos estos datos, la probabilidad de que un medicamento en fase I sea aprobado por las autoridades regulatorias es de un 7,9%. "Es decir, de todos los medicamentos que entran en fase clínica, solo 7 de cada 100 acabará siendo un nuevo fármaco", apostilla Sánchez García.
Probabilidades de aprobación según patologías
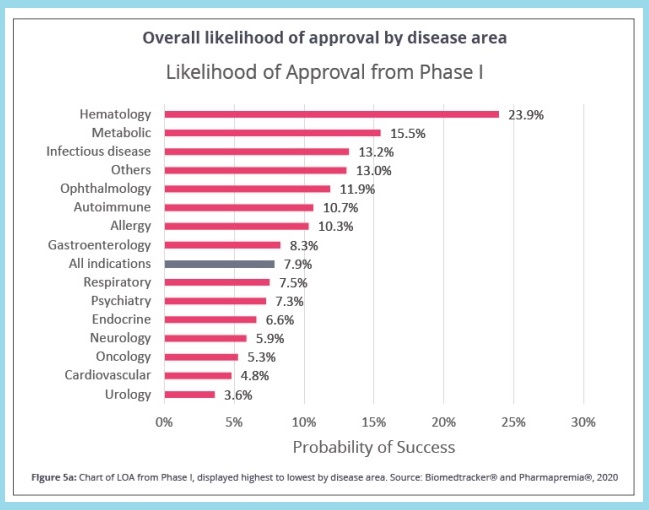
Este 7,9% es una media de todas las indicaciones; es decir, hay peores datos. En cáncer, por ejemplo, la probabilidad de pasar de fase clínica a aprobarse es del 5,3%, lo que se traduce en unos 100 fármacos en los próximos años contra el cáncer, "nada que ver con los 2.740 que hay actualmente en desarrollo".
Las áreas con mayor porcentaje de probabilidad de aprobación de medicamentos que están en desarrollo son Hematología, enfermedades metabólicas e infecciosas
Así, las áreas con mayor porcentaje de probabilidad de aprobación de medicamentos que están en desarrollo son Hematología (23,9%), seguido de enfermedades metabólicas (15,5%) y enfermedades infecciosas (13,2%). Por el contrario, en la parte inferior de la escala se sitúan los fármacos para Urología (3,6%), enfermedades cardiovasculares (4,8%) y los citados para oncología.
Además, Sánchez García indica que muchos de estos fármacos que saldrán no generarán gasto autónomamente: "Muchos de ellos saldrán para las mismas patologías o para los mismos pacientes, o una combinación de las dos cosas; de forma que dos nuevos fármacos que salen para mismos pacientes y patología no multiplican el gasto por dos, sino que se lo dividen entre dos. Por ello, hay que poner en tela de juicio el que muchos medicamentos que vayan a salir va a producir un gran incremento del gasto farmacéutico".
'Horizon scaning' o cómo analizar el gasto

En relación con el gasto que pueden generar los nuevos medicamentos que van a llegar, Sánchez García comenta que el horizon scanning debe ser completo: "Hay que analizar el horizonte, ver qué va a pasar. Eso demostraría una responsabilidad financiera importante. ¿Cuál es el problema del horizon scanning? Seleccionar una parte y estudiar solo eso. Pero, a la hora de estudiar el coste, hay que tener también en cuenta el coste de las terapias a las que se van a sustituir. Y también hay que tener en cuenta los medicamentos que van a perder la patente y van a experimentar rebajas del precio del 40%, 50% o incluso superiores. Y esta es la parte que a veces no se tiene tanto en cuenta". A su vez, las administraciones tienen unas herramientas para fijar el precio, "porque este es un sector de precios regulados. No es el Far West".
La industria farmacéutica no parece que vaya a tener un incremento de la rentabilidad demasiado alta
Sánchez García ha mencionado también un informe realizado por Deloitte, que analiza cada año la rentabilidad esperada de los productos que van a salir al mercado (ingresos menos costes), y muestra una tendencia de la rentabilidad decreciente. En concreto, la rentabilidad esperada tuvo el pico más alto de los últimos años en 2014, con un 7,2%, para ir bajando progresivamente. Así, en 2018 fue de un 3,5%; bajó drásticamente en 2019 a un 1,6%, para subir levemente en 2020 a un 2,5%. "En 2020 hubo un pequeño repunte y a ver qué pasa en 2021. Pero mucho me temo que no volveremos a ver una línea ascendente".
La industria farmacéutica no parece que vaya a tener un incremento de la rentabilidad demasiado alta, a juicio del director del departamento de Estudios de Farmaindustria. ¿Por qué?". Hay tres motivos fundamentales: "Como explica el informe de Deloitte, el coste del I+D se hace cada vez más alto; el nuevo tratamiento compite con otros, y también hay una presión regulatoria, especialmente en la Unión Europea".
Financiación de medicamentos
Cómo se financia y fija el precio de los medicamentos en España es un tema que abordó en el seminario Isabel Pineros, directora del Departamento de Acceso de Farmaindustria: "Los medicamentos que parecen imposibles de incluir en la financiación se están incluyendo gracias a acuerdos adicionales con la administración: desde acuerdos de riesgo compartido en función de los resultados de eficacia (cuando la administración siente que hay una incertidumbre de eficacia), y acuerdos de tipo financieros (como de techo de gasto, de precio-volumen, pagos aplazados...) para medicamentos que pueden suponer un elevado impacto".
"No se sabe cuál es el requisito para fijar el precio de una nueva indicación, un medicamento huérfano o de terapia génica"
Pineros se refirió también a un estudio europeo, Indicadores de acceso a terapias innovadoras en Europa (W.A.I.T. Indicator), que analiza los 152 medicamentos autorizados en Europa, de los que España tiene financiados solo 54 de cada 100: "El problema es que deberíamos aspirar a tener 63 de cada 100, como Francia, o 72 como Reino Unido. Para ello tenemos esperanza en los medicamentos disruptivos, la medicina personalizada, las terapias génicas...".
Para mejorar la disponibilidad y los tiempos de acceso, Pineros insistió en la necesidad de que una compañía sepa el requisito para financiar, por ejemplo, un medicamento huérfano y a qué precio. "Conocemos, de manera no escrita, que la regla para financiar un medicamento genérico es un 40% de precio inferior al original, pero no se sabe cuál es el requisito para fijar el precio de una nueva indicación, o de un medicamento huérfano que, de entrada, ya no ha podido ser ensayado en muchos pacientes y no va a poder tener un ensayo clínico al uso, o los medicamentos de terapia génica y medicina de precisión".
via Noticias de diariomedico.... https://ift.tt/3Dlc85a


No hay comentarios:
Publicar un comentario