
"Mi mayor presión es mi paciente, el que tengo al otro lado de la mesa. El paciente quiere lo mejor para sí mismo y yo quiero lo mejor para él". Así se sincera, fiel a su vocación, Ramón García Sanz, presidente de la Sociedad Española de Hematología y Hematoterapia (SEHH), al hablar con este medio sobre cómo debe ser el proceso para financiar y fijar el precio de los medicamentos en España.
Lo tiene tan claro que la SEHH, junto con la Sociedad Española de Oncología Médica (SEOM) y, en un principio (luego se desvinculó por falta de consenso interno), la Sociedad Española de Farmacia Hospitalaria (SEFH), enviaron el pasado 12 de mayo al Ministerio de Sanidad y a la Agencia Española del Medicamento y Productos Sanitarios (Aemps) un comunicado con 12 propuestas para incorporar fármacos de valor a la cartera del Sistema Nacional de Salud (SNS).
Entre otras medidas, piden "garantizar la transparencia y trazabilidad de los procesos de registro de un nuevo medicamento o indicación". Pocos días después, el Ministerio de Sanidad publicó el Documento Informativo sobre la Financiación y Fijación de Precios de los Medicamento en España, con datos actualizados a 26 de mayo.
"Para nosotros, un ejercicio de transparencia real es que los expertos que intervienen tengan nombre y apellidos" (Ramón García Sanz, SEHH)
¿Era esto lo que pedían las sociedades científicas? "Tuvimos ya una reunión con el Ministerio, donde dijimos que era necesario un ejercicio de transparencia, y por eso les agradecemos esta publicación. Nos gustaría aún más transparencia. Para nosotros, un ejercicio de transparencia real es que los expertos que intervienen tengan nombre y apellidos. Es cierto que les van a presionar, pero hay un presupuesto para pagar su trabajo. Las cosas deben ser públicas", recalca García Sanz.
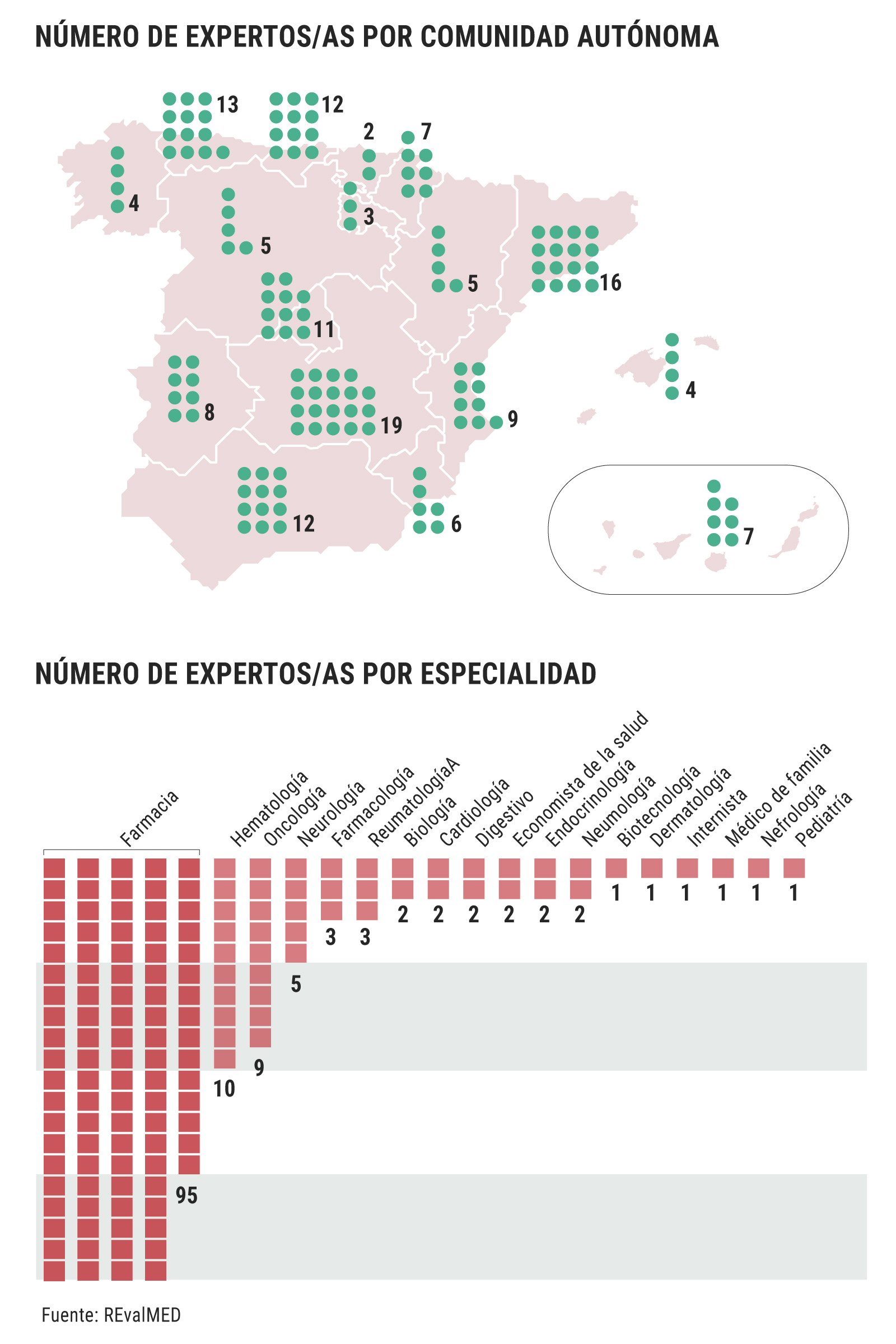
Lo que sí publica Sanidad es que hay 143 expertos, de 18 especialidades diferentes: gestores y clínicos designados por las comunidades autónomas, expertos que las sociedades científicas dicen desconocer. Ni García Sanz conoce a los 10 hematólogos que intervienen (7%) ni José Miguel Láinez, presidente de la Sociedad Española de Neurología (SEN), conoce a los 5 neurólogos (3,5%). Por su parte, Olga Delgado, presidenta de la Sociedad Española de Farmacia Hospitalaria (SEFH), indica que "se prefiere que los profesionales trabajen desde la tranquilidad que les da el anonimato, no sometidos a la presión externa".
En el mismo sentido, Néboa Zozaya, directora del Departamento de Economía de la Salud de la Fundación Weber, considera que la publicación de los nombres de los expertos causaría conflictos de intereses: "No me parece mal que el nombre sea confidencial", señala quien también ha presentado la semana pasada el informe El proceso de evaluación y financiación de los medicamentos en España: ¿Dónde estamos y hacia dónde vamos? Dicho informe incluye una encuesta a agentes del sector, donde la mayoría (más del 90%) considera que se debería reformar la evaluación de medicamentos innovadores en España.
Más transparencia
Lo que sí cree necesario Zozaya es una mayor transparencia: "Es verdad que el Ministerio de Sanidad ha dado muchos pasos hacia adelante, en una buena dirección, pero va a un ritmo lento, más lento de lo esperado". Por ello está también sobre la mesa la creación de una autoridad independiente de evaluación, "una especie de Hispanice, que pueda ser independiente. No puede ser que los mismos que evalúan sean los que deciden si se financia o no", comenta, tomando como referencia el Instituto Nacional de Salud y Excelencia Clínica del Reino Unido (NICE): "Los ingleses son pioneros en hacer las cosas bien; sobre todo, le dan mucha importancia a la transparencia, ya que es una forma de protegerse contra la crítica. También son pioneros en tener metodologías claras y homegéneas, así como en la participación de los distintos agentes".
"Sanidad ha dado muchos pasos hacia adelante, en una buena dirección, pero va a un ritmo lento, más lento de lo esperado" (Néboa Zozaya, Fundación Weber)
La industria farmacéutica, cómo no, también tiene mucho que decir y señala que ya habían trasladado al Ministerio de Sanidad gran parte de las propuestas incluidas en el comunicado de las sociedades científicas. Así, Farmaindustria defiende, según explica a este medio, que "los especialistas de cada patología, que son los que van a utilizar y consultar los informes de posicionamiento terapéutico (IPT), deberían estar más representados. Efectivamente, si sumamos los clínicos que aparecen en las tablas, su representación es de apenas un 30%, lo que está claramente desproporcionado con el resto de expertos que participan en la elaboración de los IPT. En cuanto a la transparencia, siempre es deseable en todos los procesos que ponga en marcha la Administración pública, sobre todo si se trata de expertos externos al Ministerio de Sanidad".
"Hemos detectado que hay poca atención a la evaluación económica de los medicamentos" (Joaquín López Vallés, CNMC)
Sin ir más lejos, la Comisión Nacional de Mercados y Competencia (CNMC) publicó un informe el pasado miércoles, Estudio sobre la comercialización y distribución mayorista de medicamentos dispensables a través de oficinas de farmacia en España, en el que recomendaba reforzar los IPT, desarrollando una metodología de evaluación económica, incluyendo un posicionamiento claro en terapéutica y mejorando la transparencia. "Hemos detectado que hay poca atención a la evaluación económica de los medicamentos, al análisis coste-beneficio, qué valor aportan al SNS y qué coste tienen", indicó Joaquín López Vallés, director del departamento de promoción de la competencia de la CNMC, en un briefing informativo previo a la publicación del informe.
A su vez, Carina Escobar, presidenta de la Plataforma de Organizaciones de Pacientes (POP), señala que, “en lo que respecta a la de aprobación de fármacos, desde la POP reclamamos más transparencia en todo el proceso. En el caso de los IPT, necesitamos tener feedback por parte de la Aemps sobre las aportaciones que hacemos. Es necesario que haya más transparencia, información y conocimiento de los criterios que se utilizan en el proceso de financiación de los fármacos. Desde la POP estamos preocupados por el problema de acceso a medicamentos, fundamentales para muchos pacientes que ven cómo se han dilatado los tiempos de aprobación. En ellos debemos pensar y buscar la forma de mejorar todo este proceso".
"En el caso de los IPT, necesitamos tener feedback por parte de la Aemps sobre nuestras aportaciones" (Carina Escobar, POP)
Los 143 expertos intervienen en los 7 nodos de evaluación que conforman la Red de Evaluación de Medicamentos del SNS (Revalmed), creada en mayo de 2020: enfermedades inmunomediadas, enfermedades raras (no oncológicas) y terapias avanzadas, antiinfecciosos, oncología, hematología oncológica, sistema nervioso central y patología cardiovascular y factores de riesgo cardiovascular, hematología no oncológica y respiratorio. El promedio de expertos por nodo es 15 personas.
El informe de Sanidad también da a conocer cuántos expertos participan de cada comunidad autónoma, pero se desconoce el criterio seguido ni a qué especialidad están vinculados los expertos. Así, la comunidad más beneficiada es Castilla-La Mancha, con 19 expertos (13,3%), seguida de Cataluña, con 16 (11,2%), frente a los 5 de Castilla y León (3,5%), los 12 de Andalucía (8,4%), y los 11 de Madrid (7,7%).
El mayor porcentaje de especialistas corresponde al de farmacéuticos hospitalarios: 95 (66,4%). A bastante distancia les siguen los 10 hematólogos (7%) y los 9 oncólogos (6,3%). ¿Está justificada esta proporción? Para Delgado, "la elaboración de informes y la evaluación crítica de la literatura es un proceso core de la farmacia hospitalaria. Es una parte muy importante de nuestra actividad y, por lo tanto, que participen profesionales de farmacia hospitalaria en la evaluación me parece totalmente adecuado".
"Muchos clínicos no se dedican a la evaluación, pero muchos farmacéuticos sí que lo tienen como una actividad profesional" (Olga Delgado, SEFH)
A su vez, Delgado añade que "muchos clínicos no se dedican a la evaluación, pero muchos farmacéuticos sí que lo tienen como una actividad profesional. Lo que yo creo es que debe haber siempre, por supuesto, clínicos de la especialidad que se esté tratando; porque no puedes abarcar a todas, ya que hay Hematología, Oncología, Pediatría, enfermedades raras, Digestivo, VIH, enfermedades infecciosas, Neurología... Pero no siempre vas a encontrar un grupo de profesionales de esta especialidad que tengan una capacidad y una dedicación a la evaluación y a hacer informes. Por tanto, tiene que haber un núcleo que haga el trabajo de base de elaborar el informe de la evaluación de la evidencia, un grupo de expertos que participe en cada informe, que no es por especialidad. Porque dentro de cada especialidad luego hay muchos que se dedican a ámbitos concretos".
Precisamente ese es el argumento de los prescriptores para subrayar la importancia de que la designación de clínicos no parta de las comunidades autónomas, ya que son ellos quienes tienen identificados a los expertos de cada subespecialidad. "Al final somos nosotros quienes conocemos mejor el territorio específico, porque son subespecialidades y hay que saber muy bien qué aporta un fármaco nuevo respecto al previo. No estoy pidiendo que baje la ratio de farmacéuticos hospitalarios, sino que subamos los demás", comenta Láinez.
"Una de las condiciones importantes es que los clínicos participáramos desde el principio y se estratificara por áreas de subespecialización" (José Miguel Láinez, SEN)
En su caso, aun siendo presidente de la Sociedad Española de Neurología (no es firmante del manifiesto, pero lo suscribe), admite no sentirse capaz de evaluar un fármaco, por ejemplo, para la esclerosis múltiple, "porque no me dedico a ese campo. Pero una de las condiciones importantes es que participáramos desde el principio y se estratificara por áreas de subespecialización". Y añade que no tiene ninguna duda de quiénes son los expertos en cada subespecialidad: "Una cuestión buena sería que nos pidieran listados de personas para participar en los IPT por subespecialidades. No sabemos ni siquiera qué comunidad autónoma hace los informes oficialmente. Extraoficialmente nos podemos enterar de alguna cosa...".
Láinez subraya también que los IPT les llegan muy tarde, "cuando ya se ha decidido casi todo. Y nos dan un plazo demasiado corto, cuando los plazos se dilatan mucho previamente. Aparte, nuestra participación suele tener poca repercusión".
Cómo mejorar los IPT
En el mismo sentido, García Sanz explica que "es imposible controlar todas las ramas de la Hematología, y ya no te digo de la Oncología, con 9 o 10 expertos. Sanidad piensa que teniendo un hematólogo ya tiene un experto en cualquier cosa. A mí, por ejemplo, me puedes pedir que te evalúe fármacos para mieloma o para linfoma, pero no me pidas que te evalúe fármacos para mielodisplasia o coagulación, porque no estoy capacitado para ello. Eso es cierto".
"Seguimos viendo IPT con aberraciones totales, de un fármaco que demuestra beneficios frente a otro, y te dicen que no es una alternativa" (Ramón García Sanz)
Sin embargo, sí están capacitados para saber qué aporta un fármaco nuevo respecto al previo. En esto el presidente de la SEHH pone ejemplos: "Seguimos viendo IPT con aberraciones totales, de un fármaco que demuestra beneficios frente a otro, y te dicen que no es una alternativa; o comparar un fármaco nuevo (no puedo decir nombre) para linfoma de células del manto, que ya no sabes qué hacer y es una solución para muchos pacientes, y te dicen que es mucho más caro que la alternativa. Y dices: ¿Qué alternativa? Te contestan: R-CHOP. Pero si ese paciente ya ha recibido R-CHOP. ¿Cómo me puedes comparar una cosa que sabes que no es eficaz y es tóxica con otra que sabes que puede ser eficaz? La quimioterapia es tóxica para todo el mundo, pero uno asume los beneficios de esa toxicidad. Si no va a ser eficaz, ya es inasumible...".
Al final, el quid de la cuestión es el tiempo que tarda el paciente en acceder al medicamento que necesita, como subrayan los expertos. "El mayor problema que tenemos no es el número de fármacos no financiados, que probablemente en Neurología son pocos, sino el retraso enorme que tenemos respecto a Europa. Eso sí es un problema importante", señala Láinez.
Por su parte, Farmaindustria considera que “al vincular el IPT con el proceso de financiación se ha generado otro cuello de botella adicional: mientras el IPT se está realizando, está paralizado el trámite de financiación. Previamente a 2020, estos IPT no eran una exigencia para llevar un nuevo medicamento a la Comisión Interministerial de Precios de los Medicamentos (CIMP); se trabajaba de manera paralela y no secuencial. Hoy, este condicionante está contribuyendo a empeorar los indicadores de acceso a la innovación en España".
"Se debería desarrollar un proceso acelerado que garantice el acceso a los pacientes" (Farmaindustria)
Igualmente, García Sanz se queja del resultado final: "Los fármacos en España se retrasan, y estamos de la mitad para abajo de Europa, al nivel de Chequia, Lituania, y por detrás de Francia, Alemania y Reino Unido; incluso por detrás de Portugal". Y añade: "Hay una cosa que al Ministerio de Sanidad se le olvida. Cuando los fármacos se aprueban en España, ya los ha evaluado la Agencia Europea del Medicamento (EMA)".
De hecho, esto se ha puesto sobre la mesa en multitud de ocasiones. Una de las más recientes, en la IV Cumbre Española Contra el Cáncer, celebrada en febrero de 2022. Aquí los expertos alertaron de que el 50% de los medicamentos aprobados por la EMA no están financiados en España, y se puso el acento en que España es el país del G5 con menor número de moléculas financiadas en los últimos años del total de las aprobadas por la EMA.
Acceso a fármacos
Esta desventajosa posición de España respecto a Europa aparece plasmada también en el informe anual Indicadores de acceso a terapias innovadoras en Europa, elaborado por la consultora Iqvia a petición de la Federación Europea de Asociaciones de la Industria Farmacéutica (Efpia), donde se aprecian diferencias abismales en Europa, que abarcan desde un tiempo de acceso a un fármaco de 4 meses hasta 2 años y medio para el mismo medicamento.
¿Dónde se sitúa España? Si en 2021 estaba en los 453 días, en el informe publicado en abril de 2022, con datos actualizados a enero de este año, está en 517 días, tiempo que transcurre entre la autorización comercial y la disponibilidad para el paciente; algo peor que Grecia, que tarda 498 días, pero mejor que Bélgica, con 534, o Irlanda, con 541, y a bastante distancia de Alemania, donde la espera es de 133 días; Francia, de 240 días; Inglaterra, de 340, o Italia, de 429.
En resumen, hay variaciones de hasta el 90% entre los países del norte y oeste de Europa, que según el informe de 2021 tardan entre 100 y 200 días, y los países del sur y el este de Europa, donde los pacientes esperan entre 600 y 1.000 días desde que se autoriza la comercialización del fármaco.
Aparte, España tiene el porcentaje de medicamentos disponibles más bajo de Europa. Así, a fecha de enero de 2022 sólo estaban disponibles en España 85 de los 160 fármacos aprobados en la Unión Europea en el periodo 2017-2020, lo que supone el 53%. Una vez más, diferencias con Alemania, donde el porcentaje es del 92%; Italia, 79%; Inglaterra, del 68%, y Francia, 66%. En resumen, desde 2018 el porcentaje de disponibilidad en España ha disminuido en nueve puntos porcentuales.
Frente a esto, Sanidad tiene un argumento al que suele recurrir y que se ve reflejado en el documento recién publicado: "La autorización de comercialización es el primer requisito para que el medicamento llegue a los pacientes".

Pone, pues, la pelota en el tejado de los laboratorios farmacéuticos, como también hizo hace unas semanas Patricia Lacruz, directora General de Cartera Común de Servicios del SNS y Farmacia, en la IV Jornada Nacional de Biosimilares, celebrada el 10 de junio en el Congreso de los Diputados. Allí, al hablar de los biosimilares, subrayó que "el promedio de días desde que se autoriza por la Comisión Europea hasta que el laboratorio solicita la comercialización en España es de 233 días". Y remarcó que hay un biosimilar reciente, autorizado por la Comisión Europea en agosto 2020/21, el ramucirumab, "que aún no ha solicitado la comercialización en nuestro país".
"Tienen que incorporar evaluación económica, pero los evaluadores no saben de evaluación económica" (Néboa Zozaya)
De los 143 expertos que intervienen en España, solo hay dos economistas de la salud, que suponen un 1,4% del total. Zozaya comenta que "está bien que se hagan los IPT, que están operativos desde 2013. Antes eran solo para algunos medicamentos, no eran homogéneos, no había evaluación económica y tardaban en publicarse. Ahora han incluido la evaluación económica, que es algo que se venía reclamando desde hace muchísimo tiempo. Pero están aún en fase piloto, de aprendizaje. Entendemos que con el tiempo esto se agilizará".
Señala que el Ministerio de Sanidad tiene plazos muy cortos: "Su objetivo es hacer la evaluación clínica en 20 días y la económica en 10, como señalan en el Plan de consolidación de IPT, publicado en 2020. Eso es en teoría, porque en la práctica el tiempo es mucho mayor. Pero ahora está mucho más articulado y te dicen qué pasos hay que seguir, cuáles son los plazos máximos", explica.
Eso sí, señala que hay un aluvión de IPT, tal y como ha reconocido el Ministerio de Sanidad, al decir que realizan un IPT cada tres días: "Por mucho personal que tengan, así es muy difícil hacerlo bien. Además, Revalmed trabaja en red".
Zozaya comenta que con Revalmed se está yendo un poco sobre la marcha: "Tienen que incorporar evaluación económica, pero los evaluadores no saben de evaluación económica. De hecho, el Ministerio está dando formación de economía de la salud y evaluación económica a los evaluadores. Pero sería mejor contar con gente que sepa bien desde el principio".
via Noticias de diariomedico.... https://ift.tt/QSsmT3P


No hay comentarios:
Publicar un comentario