
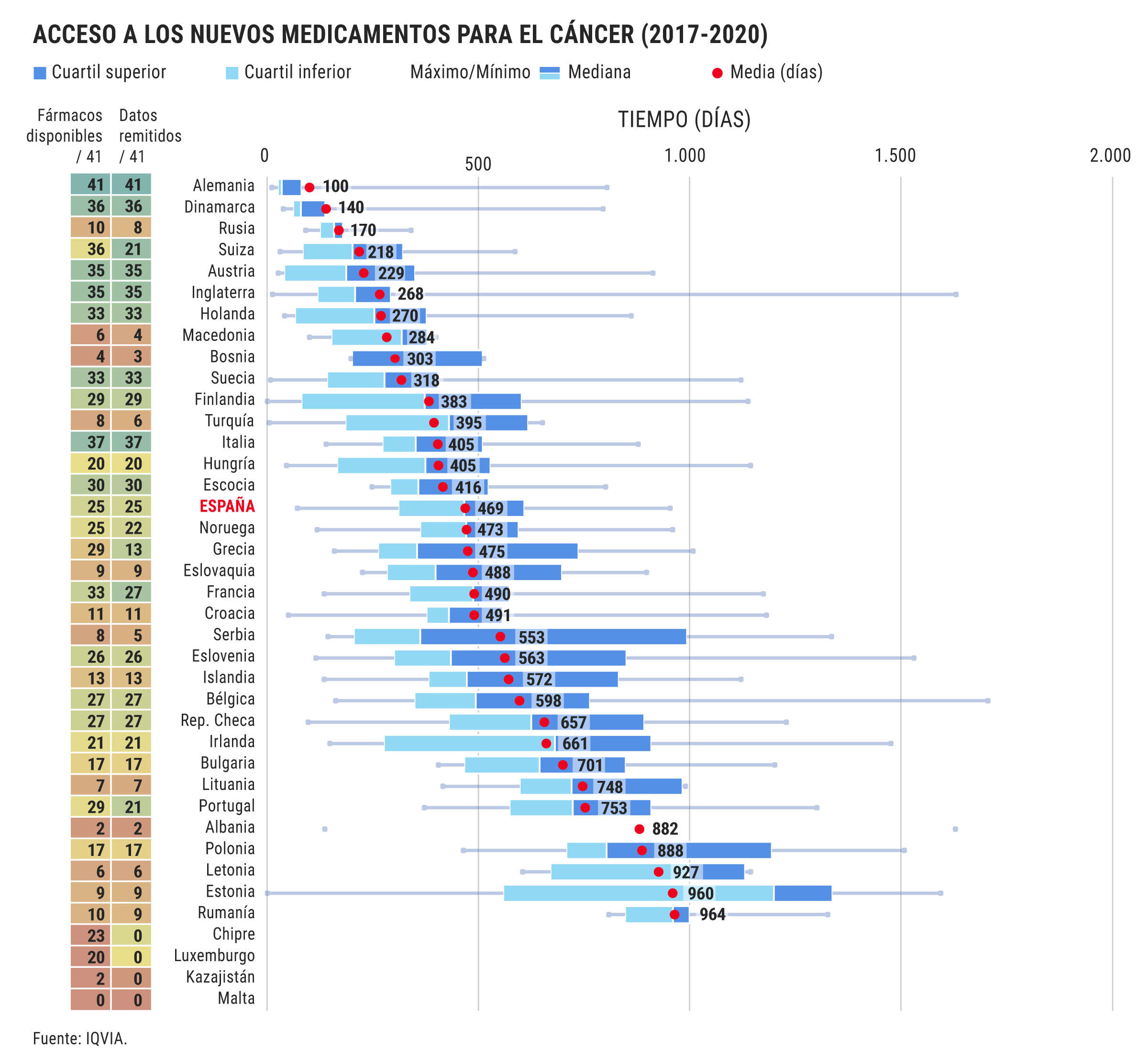
Pocos, con restricciones y tarde. Así es como se están incorporando los nuevos medicamentos contra el cáncer en España. Las nuevas terapias oncológicas tardan de media ya 469 días desde que son aprobadas por la Agencia Española del Medicamento (EMA) y hasta que España decide incorporarlas a la financiación pública.
Además de este retraso que en algunos medicamentos llega a rozar ya los 1.000 días de espera para obtener una decisión de la Administración sobre su reembolso en la sanidad pública, España es especialmente restrictiva: de los 41 nuevos fármacos aprobados contra el cáncer en Europa entre 2017 y 2020 sólo ha incorporado a fecha de 2022, 25 y de ellos, además, 10 han llegado con restricciones de uso extra sobre las que había establecido la EMA en su aprobación.
Así lo constata el informe WAIT que ha elaborado la consultora Iqvia por encargo de la patronal de laboratorios europea Efpia y en el que las cifras de retrasos sufridas en España para el acceso a nuevos medicamentos oncológicos, de 469 días, contrastan con las de otros países de su entorno como Alemania, con apenas 100 días de retraso y que incorpora el 100% de los fármacos. El mal español se observa, con todo, también en algunos de sus vecinos como Francia o Portugal.
La frialdad de las cifras ha empezado a dejar paso ya a la dramática realidad con nombres y apellidos. Historias de pacientes con cáncer de mama metastásico, donde cada minuto cuenta, que han empezado a saltar a los grandes titulares de la prensa generalista en las últimas semanas por haberse visto abocadas a pagar de su bolsillo las nuevas terapias, a la espera de que la Administración española las saque del limbo burocrático y decida sobre su financiación pública.
Diez terapias para el cáncer de mama, en el limbo
“La situación empieza a ser dramática. Los retrasos desde que la Agencia Europea aprueba los medicamentos y hasta que los tenemos financiado son inaceptables y sobre todo para tratamientos como éstos que aportan mucho valor”, afirma Aleix Prat, presidente del grupo de investigación Solti de cáncer de mama.
Según su recuento hay al menos 10 terapias (nueve fármacos y una combinación) para el cáncer de mama que están ya aprobadas por Europa “en algunos casos desde hace ya dos años” y que no están disponibles en España. “Podemos discutir el valor que cada uno de ellos aporta y lo que estamos dispuestos a pagar por ellos, pero lo que no pueden es quedarse en un limbo de espera; debe haber un proceso rápido y transparente en el que sepamos en todo momento en qué situación está el fármaco, qué oferta se ha hecho, por qué razón se ha rechazado o no decidido sobre su financiación porque los pacientes cada vez se informan más, saben perfectamente cuándo una nueva terapia se ha aprobado en la EMA y piden a su vez explicaciones al médico sobre por qué no se la administra”.
Una de cada tres mujeres con cáncer de mama, sin acceso a innovaciones aprobadas
La situación de retraso y falta de acceso a estos fármacos, especialmente dramática en cáncer de mama y de pulmón, está lejos de ser un caso puntual. Según el presidente de Solti, “en cáncer de mama los fármacos que están a la espera de una decisión en su mayoría están dirigidos a cáncer de mama HER2 positivo, lo que representa aproximadamente un 30% del cáncer de mama. Es decir, grosso modo podríamos decir que una de cada tres pacientes de cáncer de mama tendría un nuevo medicamento aprobado por Europa para tratar su enfermedad que no está financiado todavía en España. Y eso es muy grave”.
“En enfermedad precoz -continúa el presidente de Solti- estamos hablando de medicamentos para potencial curación de un tipo de cáncer de mama muy agresivo en mujeres jóvenes y que no están financiado. Y en el contexto metastásico hay fármacos a la espera que han demostrado alargar la vida y la calidad de vida y han sido valorados en el rango de beneficio más alto en la escala de evaluación de ESMO, de la Sociedad Europea de Oncología Médica”.
La lista de las 10 terapias para cáncer de mama que según detalla el grupo de investigación Solti España no habría incorporado todavía pese a su aprobación en ocasiones hace más de un año en la EMA incluye en concreto: Pertuzumab (como adyuvante para cáncer de mama HER2+ temprano), Neratinib (adyuvante para cáncer de mama HER2+ temprano), Olaparib (cáncer de mama HER2- metastásico con mutación germinal de BRCA), Talazoparib (cáncer de mama HER2- mestastásico con mutación germinal de BRCA), Tucatinib (cáncer de mama HER2+ metastásico), Trastuzumab/Pertuzumab subcutáneo (cáncer de mama HER2+ temprano o metastásico), Trastuzumab deruxtecan (cáncer de mama HER2+ metastásico), Sacituzumab Govitecan (cáncer de mama triple negativo metastásico), Pembrolizumab (cáncer de mama triple negativo metastásico) y Pembrolizumab (cáncer de mama triple negativo temprano). Otras, como Alpelisib, la única terapia para pacientes con cáncer de mama avanzado RH+/HER2- con mutaciones en PIK3CA, conseguían incorporarse al sistema sanitario español este invierno, pero tras un largo periplo desde 2020.
Pacientes de cáncer de pulmón, cáncer gástrico o leucemia a la espera
El retraso en el acceso a estas terapias no es exclusivo del cáncer de mama. La lista de fármacos autorizados por Europa pero sin comercialización todavía en España incluye fármacos para el cáncer gástrico como Ayvakyt, para la leucemia mioloide aguda como gasdegib maleato, o para el cáncer de pulmón como Lorlatinib y Rozlytrek. Y el problema crece rápidamente: esta misma semana, por ejemplo, la Comisión Europea aprobaba Capmatinib como monoterapia para el tratamiento de pacientes adultos con cáncer de pulmón no microcítico avanzado.
El problema de estos retrasos en la incorporación de los nuevos fármacos es que rápidamente acaban convirtiéndose en problemas de inequidad en el acceso a las nuevas terapias.
Eva María Ciruelos, oncóloga médica coordinadora de la unidad de mama en el Hospital Doce de Octubre de Madrid y de HM Hospitales explica que los médicos se enfrentan a la tesitura de saber que hay fármacos aprobados y conocer los estudios sobre sus buenos resultados pero no poder ofrecérselos a los pacientes.
Y éstos, a su vez, cada vez con más frecuencia cuentan con su propia información y los reclaman. “Se trata de fármacos que pueden costar cuatro o cinco mil euros el ciclo y que pueden precisar un año y medio de tratamiento. Y antes esa situación, algunas autonomías se reúnen internamente y en ocasiones llegan a acuerdos de acceso precoz a estos fármacos que ya están aprobados por la EMA pero siguen a la espera de la decisión del Ministerio de Sanidad sobre su financiación. A veces esas autonomías permiten el acceso a los fármacos para sus pacientes o para un grupo de pacientes más restringido que el había autorizado Europa".
Inequidad en el acceso dependiendo del hospital o la autonomía a la que se pertenezca
"En otras ocasiones -continúa Ciruelos- es el propio hospital el que, dependiendo de la sensibilidad de la gerencia y de su capacidad, lo financia a la espera de que el Ministerio tome la decisión y es ahí cuando se produce un problema importante porque, aunque genere disconfort decirlo en voz alta, la consecuencia obvia de estos retrasos es que en ese año y medio o dos años de espera puede ser que un paciente consiga un fármaco o no lo consiga dependiendo del hospital al que pertenece”.
Y por eso, en opinión de Ciruelos es urgente que el proceso de aprobación y de decisión de reembolso de estos medicamentos sea rápido tanto si el resultado es positivo como si es negativo, pero rápido. Además debe ser transparente y justificado contando con la opinión de profesionales que conocen esa patología y descontando de los costes del fármaco los ahorros que puede generar por menores bajas, menor mortalidad, etc”.
via Noticias de diariomedico.... https://ift.tt/GxETdlO


No hay comentarios:
Publicar un comentario