
La ciencia que estudia el potencial terapéutico del cannabis se hizo fuerte gracias a un judío de origen búlgaro y a cinco kilos de hachís libanés. Corría la década de 1950 cuando el joven químico Raphael Mechoulam, cuya familia había llegado a Israel tras el horror nazi, buscaba posibles temas de investigación que impresionaran a sus colegas del Instituto Weizmann de Ciencias, en Rejovot (Israel). Así como se topó con el enigma del cáñamo. Mientras que la morfina había sido aislada del opio hacía siglo y medio y se empleaba en la clínica, el cannabis era aún una caja negra farmacológica sobre la que muy pocos científicos trabajaban entonces. Según ha comentado públicamente Mechoulam, en aquellos momentos los Institutos Nacionales de Salud estadounidenses (NIH) rechazaron sus propuestas para investigar en esta droga con el argumento de que la marihuana no era un problema estadounidense.
Para poder identificar los compuestos activos de la planta y conocer en profundidad cómo actúan sobre el organismo, el farmacólogo reconoció que llegó a saltarse la burocracia y recurrió a contactos en la policía, que le prestaron parte de algún contrabando. En una entrevista incluso recordó haber ido en autobús a su laboratorio con cinco kilos de hachís libanés.
Sea como fuera la recogida de muestras, lo primordial para la historia de la ciencia es que a principios de la década de 1960 el grupo de Mechoulam publicó un artículo sobre la estructura del cannabidiol (CBD) -uno de los principales compuestos de la marihuana que ya se había aislado, pero del que apenas se sabía nada- y en 1964 hizo público por primera vez el aislamiento y la caracterización del tetrahidrocanabinol (THC), un importante componente psicoactivo de la planta Cannabis sativa.
Esos estudios reavivaron el interés por la composición química de la marihuana, con investigaciones en todo el mundo que han dado sus frutos durante las siguientes décadas. Poco a poco se han desentrañado los compuestos presentes en la planta asociados a determinados efectos biológicos (fitocannabinoides), y en ese viaje (científico) se ha topado con una “plantación biológica de cannabis” en nuestro organismo: el sistema endocannabinoide, por el cual el cuerpo produce sustancias similares a las de la marihuana, los llamados endocannabinoides.
Así, en 1988, el equipo de Allyn Howlett en la Universidad de Saint Louis, en Misuri, demostró que los efectos sobre la función celular de los cannabinoides se alcanza con la activación de un receptor específico en la proteína G. Dos años más tarde, otros científicos de los NIH identificaron lo que ya es conocido como receptor cannabinoide tipo 1 (CB1), el primer receptor cannabinoide que se ha descrito y que se encuentra sobre todo en el sistema nervioso, pero también en el tejido conectivo y en diferentes glándulas y órganos.
Después vendría el CB2, que se localiza principalmente en las células inmunitarias, según mostraron las investigaciones de Sean Munro y otros científicos del Laboratorio de Biología Molecular MRC, en Cambridge. Los receptores endocannabinoides se distribuyen por todo el cuerpo y se cree que son más numerosos que los de cualquier otro sistema receptor. Otra clave importante del sistema endocannabinoide la dio también el grupo de Mechoulam, que identificó el primer endoncannabinoide o cannabinoide endógeno. Lo llamó "anandamida" de la palabra sánscrita "ananda" (felicidad).
Los endocannabinoides son neuromoduladores, como la dopamina. Además de la anandamida, que se localiza principalmente en el cerebro, otro endocannbinonide bien caracterizado es el 2-araquidonoil glicerol (2-AG), ubicado en el resto del cuerpo.
Desde luego la función biológica de estos receptores y ligandos no es la de sentir los efectos de la maría. El sistema endocannabinoide está presente en muchos procesos vitales, entre ellos algunos implicados en el apetito, el estado de vigilia, el dolor y la memoria. Recientemente se ha comprobado que la señalización endocannabinoide es fundamental para el desarrollo y maduración de los circuitos neuronales; también que es clave en la regulación de los procesos de recompensa.
- Cannabis medicinal: "La situación de España es difícil de explicar: se puede cultivar, fabricar, exportar... pero aquí no es accesible"
- Legalización del cannabis: el 90% de la población pide un cambio al que se oponen políticos y científicos
- El cannabis causa aislamiento social y esta es su base bioquímica
Sin embargo, todo ese despliegue del conocimiento de la biología de los cannabinoides y del sistema endocannabinoide no ha tenido un reflejo en los avances clínicos con el cannabis medicinal. Los especialistas reconocen que faltan ensayos clínicos robustos que puedan avalar desde el rigor científico sus potenciales indicaciones.
La planta del cannabis cuenta con más de 460 compuestos, de los que se conocen al menos once familias de cannabinoides (más de cien tipos), expone a DM Jesús de Santiago Moraga, anestesiólogo de la Unidad de Dolor del Hospital Quironsalud de Tenerife, y de la Sociedad Española del Dolor (SED). Los fitocannabinoides más estudiados en el contexto terapéutico son el THC y CBD, que actúan de forma diferente sobre los receptores cannabinoides, de ahí que el CBD no induzca los efectos psicoactivos del THC y en cambio ejerza una acción antiepiléptica. “No obstante, hay que tener en cuenta que además de los cannabinoides, la planta tiene otros compuestos como los terpenoides y flavonoides, que le dan un carácter sedante o euforizante”, afirma De Santiago.
“Es muy difícil sintetizar toda la planta en un medicamento. Si nos centramos solo en THC o CBD, obtendremos un fármaco a base de cannabis, con unos usos específicos, pero no dará el mismo juego que la planta, porque no se pueden cambiar las concentraciones de los compuestos. Por otro lado, al utilizar el cannabis con fin medicinal tienes que tener una radiografía exhaustiva de lo que lleva cada cepa”.

La variabilidad de los compuestos en el cannabis puede ser una ventaja, pero también una de las razones por las que resulta complicado hacer ensayos homogéneos. En el uso de este preparado como analgésico, que es uno de sus potenciales efectos terapéuticos, la Sociedad Internacional del Dolor (IASP) concluyó recientemente que la evidencia científica es limitada en el tratamiento del dolor crónico. En ese mismo posicionamiento, la IASP también reconoce que "no deseamos descartar las experiencias vividas de personas con dolor que se han beneficiado de su uso”.
Además, añade De Santiago, la Federación Europea del Dolor (EFIC) –miembro de la IASP, al igual que la SED- matiza que se podrían utilizar fármacos a base de cannabis para tratar el dolor neuropático crónico tras haber agotado la primera y segunda línea terapéutica, dentro de un contexto multidisciplinar y como uso compasivo.
Dolor neuropático
“Según una encuesta de la SED, el 8% de población general tiene dolor neuropático en España (ciática, cervicalgia, diabetes); de ellos, un 30% sufre dolor crónico persistente a pesar de los tratamientos y, a su vez, una parte de estos, dolor persistente severo”, aporta De Santiago. “Son personas con muy poca calidad de vida. No responden a los tratamientos habituales y a menudo acuden en busca de alternativas, incluso en el mercado negro. En muchos países se está utilizando el cannabis medicinal bajo supervisión médica y se ha apreciado en cierto nicho una mejoría en la calidad del sueño, la función física y el dolor. Si estuviera regulado en España, podría hacerse investigación clínica con más facilidad y ofrecer una oportunidad algunos pacientes”.
En la misma línea se manifiesta Juan Pablo Leiva, responsable del Equipo de Soporte Hospitalario y Atención Paliativa del Hospital Manacor de Mallorca, y presidente de la Sociedad Española de Cuidados Paliativos (Secpal). “Utilizados de una manera terapéutica controlada no estamos introduciendo sustancias ajenas a la biología humana; se correlacionan con la biodinámica neuroquímica del ser humano”. Para este experto, la administración de cannabinoides es comparable a lo que ocurre con los opioides: “No usamos drogas como la heroína que tienen perfiles que generan más adicción que beneficio, pero sí utilizamos esos canales neurológicos” para obtener un control de ciertos síntomas.
En enfermedades no oncológicas
Con esa comparación, Leiva no quiere llevar a equívocos, pues el cannabis medicinal puede ser útil también en pacientes no oncológicos. “Los cannabinoides podrían ser útiles en enfermedades neurológicas (esclerosis múltiple, esclerosis lateral amiotrófica); respiratorias (EPOC); renales (enfermedad renal crónica avanzada), y en diferentes tipos de cáncer. En esas y otras patologías ayudarían a controlar síntomas como dolor, náuseas y vómitos, astenia, y disnea, entre otros”.
No obstante, el presidente de Secpal recuerda que “todavía tenemos que identificar los escenarios clínicos que pueden beneficiarse de los cannabinoides. Por ejemplo, pueden servir para el control de síntomas de los pacientes con enfermedad renal crónica avanzada donde el abanico de opciones es bastante restringido. Este es un perfil de enfermo que debería explorarse”.
De Santiago remata: “Desde la SED llevamos un año esperando a los permisos necesarios para iniciar un estudio randomizado con cannabis medicinal en dolor lumbar; es demasiado tiempo. Necesitamos que esté regulado”.
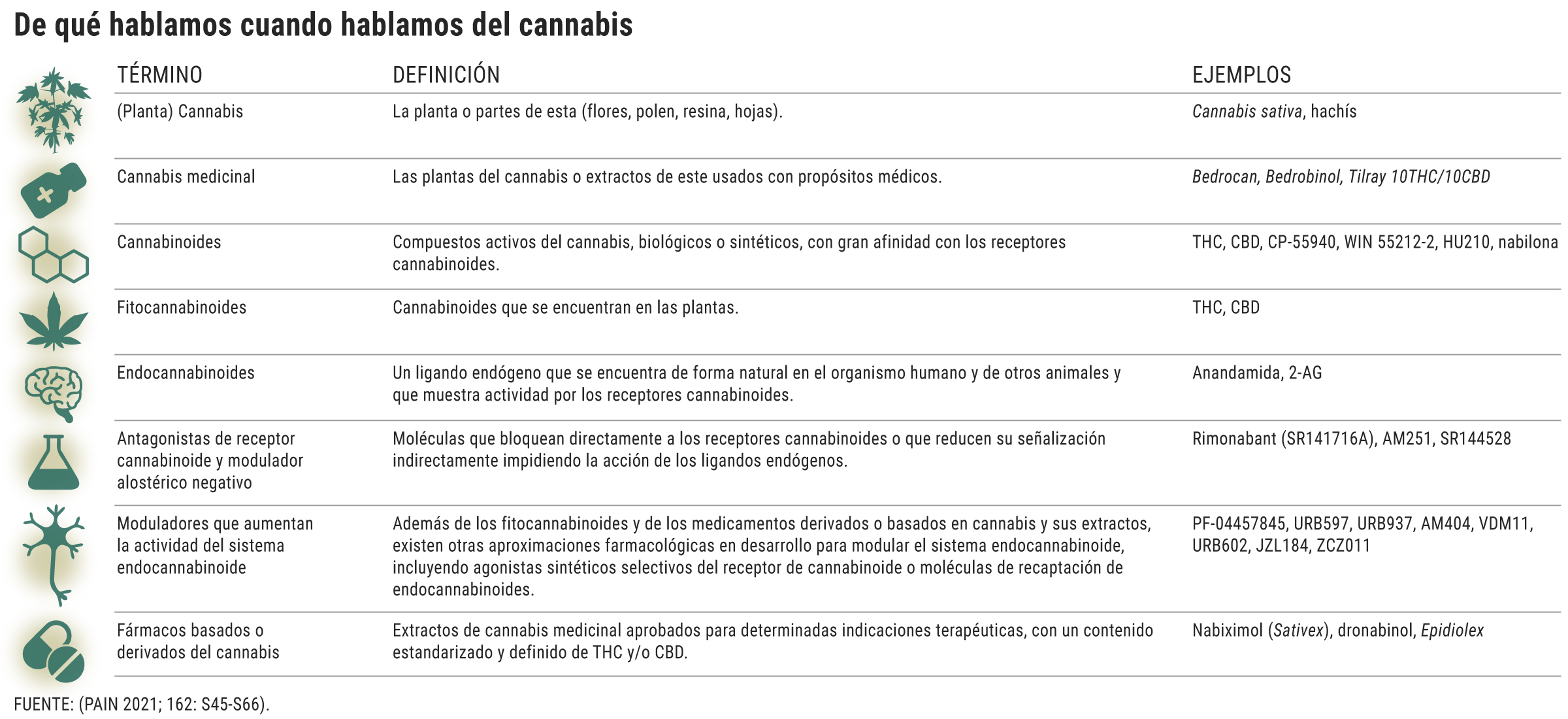
Con el cannabis de uso terapéutico priman los trabajos descriptivos; los estudios randomizados no son ni lo suficientemente largos, ni se han hecho en poblaciones o con productos homogéneos. La falta de evidencia se debe en parte a la prohibición, la mezcla de elementos estudiados y los sesgos, sintetiza Carlos Goicoechea García, catedrático de Farmacología y director de Ciencias Básicas de la Salud en la Universidad Rey Juan Carlos, en Madrid.
“La investigación clínica ha estado en parte parada por las prohibiciones sobre la planta, pero mientras, los pacientes han seguido utilizando cannabis de origen irregular para controlar sus dolencias, con más o menos éxito. Llega el momento en que como sociedad nos planteamos hacer investigaciones serias. Faltan estudios de calidad, lo que es inherente a la forma en que ha entrado el cannabis medicinal en la sociedad: con el uso irregular y descontrolado”. Goicoechea argumenta que el paciente ha usado el cannabis de formas diferentes –inhalado con vaporizadores, en aceites por vía oral o tópica, pero también fumando-, y ha recurrido a plantas con diversas concentraciones de principios activos.
Otra dificultad añadida para realizar estudios de calidad son los sesgos; “por ejemplo, el sesgo de aleatorización: la planta huele y eso complica encontrar un buen placebo para hacer el doble ciego. También lo dificulta el que una proporción de los pacientes estudiados ya hayan estado en contacto con el cannabis por consumo recreativo, pues van a reconocer los efectos”. El farmacólogo menciona además el sesgo -que no es exclusivo de este campo de investigación- de las publicaciones en revistas científicas: en general, aparecen menos resultados positivos sobre el cannabis en revistas como JAMA o The New England que en Journal Cannabis Research.
Vías de administración
Una duda que se podría despejar con estudios de calidad es la mejor vía de administración del cannabis, si bien Leiva duda de que se identifique una que sirva para todo: “Dependerá de los síntomas que se busquen controlar”.
De Santiago añade que en el control del dolor, grosso modo, “las guías de tratamiento recomiendan el uso del aceite por vía oral o sublingual, empezando por concentraciones de CBD que irán aumentando hasta alcanzar un tope; si no hay eficacia, se añade poco a poco THC. Es lo ideal porque se trata de administrar el cannabis como un medicamento al uso”. La realidad es que la vía inhalada es la más usada por los pacientes, “porque su efecto es más rápido que con la vía oral; además de que es más barata”, apunta De Santiago, quien recuerda que nunca se recomienda fumar, sino inhalar con un vaporizador específico.
El ‘fantasma’ de la adicción y la psicosis
Las alteraciones que afectan a la esfera cognitiva y la adicción son de los miedos recurrentes a la hora de considerar el cannabis como un tratamiento. Leiva admite lo espinoso del asunto, pues “vemos el abuso en nuestras consultas de cuidados paliativos, pero en muchas ocasiones no en el enfermo, sin en los familiares que acceden a su medicación”. Goicoechea también alude a los casos en que se pasa del uso medicinal al lúdico, “pero esto puede ocurrir con otras sustancias. Hay que asumir que ningún fármaco se encuentra exento de efectos secundarios, de ahí que estén en manos de profesionales”.
Al iniciar el tratamiento siempre hay que descartar contraindicaciones como un historial de abuso a tóxicos (alcohol o cannabis de uso recreativo), así como antecedentes de patología psiquiátrica y enfermedad cardiovascular descompensada, entre otras. “Siempre que se detecten las contraindicaciones y se realice un buen seguimiento a los pacientes, los efectos secundarios que puedes encontrar son similares a los de otros tratamientos analgésicos, como la somnolencia, náuseas y vómitos, visión borrosa e hipotensión”, dice De Santiago.
Los datos sobre efectos secundarios graves están supeditados a lo que se sabe del uso lúdico del cannabis, que “no tiene nada que ver con el uso terapéutico”. Tanto la forma de administración, como las dosis y la concentración de THC son totalmente diferentes.
En el uso recreativo del cannabis se ha constatado que el consumo produce a largo plazo “riesgo de abuso y deterioro cognitivo, pérdida de memoria, y en gente joven, efectos psicóticos”, todo ello es muy grave, pero, insiste el especialista de la SED, “no es cannabis medicinal”.
Explica que “comprar el cannabis en el mercado negro es como comprar un fármaco por internet. Al no estar regulado, no se aplican criterios de calidad, ni se comprueba por ejemplo que las plantas no tengan hongos ni metales pesados, o que las cepas cultivadas se correspondan con lo que se quiere consumir, con una trazabilidad obtenida mediante análisis de laboratorio, para que el usuario esté seguro. En el cannabis medicinal, el médico debe saber que el paciente recibe lo que ha prescrito. El tratamiento con cannabis solo tiene sentido de esta manera. Si no, es ir a ciegas”.
De Santiago conoce de primera mano la experiencia en Israel, donde ha estado trabajando en una unidad de cannabis medicinal. “Allí con el tiempo han acotado y regulado determinadas cepas de la planta, con unas concentraciones de CBD y de THC concretas y un perfil terpenoide identificado. El médico prescribe la planta específica y otorga al paciente una licencia limitada en el tiempo, que el enfermo debe renovar”, explica. “De esta forma, el sistema asegura que titulas bien y despacio las concentraciones de cannabinoides y que detectas los efectos secundarios, porque la clave de todo es el seguimiento”. También destaca que, al igual que en otros países donde el cannabis medicinal está regulado, como Canadá, el médico prescriptor debe haber superado una formación especializada.
Información sin prejuicios
En medio de la polémica, hay consenso sobre el papel insustituible de los médicos en el manejo de esta sustancia. Juan Pablo Leiva concluye que “la conversación en cuanto al uso de cannabinoides es un asunto científico, no político”. Ahora cree que la principales directrices de la investigación deberían orientarse a “clarificar los potenciales ámbitos de aplicación clínica”, pero también a “disminuir tabúes” en la población general y en la comunidad científica, donde aún hay desconocimiento sobre este tema. En una encuesta sobre profesionales sanitarios en Australia publicada en Plos One, la mayoría afirmaban extraer la información sobre el cannabis de los medios de comunicación, recuerda Goicoechea.
“Podemos mirar para otro lado y pensar que la gente no usa cannabis para el tratamiento del dolor, pero lo están haciendo”, razona este profesor. “Así que vamos a controlarlo y a ampliar el conocimiento sobre sus potenciales beneficios”.
via Noticias de diariomedico.... https://ift.tt/3nrreld


No hay comentarios:
Publicar un comentario