
El Ministerio de Sanidad aprobó a comienzos de diciembre la financiación de dos nuevos medicamentos huérfanos: Evrysdi, para la atrofia muscular espinal, y Voxzogo, para tratar la acondroplasia -trastorno genético en el crecimiento de los huesos que provoca enanismo- causada por la mutación de un gen llamado FGFR3, confirmado por pruebas genéticas. Aparte, ha destinado una partida de 50 millones de euros en los Presupuestos Generales de 2023 para la mejora de la atención sanitaria a pacientes con enfermedades raras.
¿Significa esto que la administración está dando nuevos pasos? Según explica la Asociación Española de Laboratorios de medicamentos huérfanos y ultrahuérfanos (Aelmhu) a este medio, se atisba cierta luz, pero hay claroscuros: "Miramos con nuevas esperanzas todos los cambios y avances que tanto a nivel nacional -y también regional- se van produciendo"; aun así, siguen reivindicando que "España sea capaz de simplificar los procesos de aprobación de estos productos como hacen otros países de nuestro entorno".
Bastan estos datos: "Nuestro país tarda un 70% más en evaluar los productos huérfanos, pasando de un promedio de 214 días entre el inicio del expediente y su envío a Cartera Común en 2013, a los 363 días actuales para los medicamentos huérfanos".
"Las enfermedades raras requieren de un abordaje diferente al habitual: más ágil y con criterios de evaluación propios"
Respecto al año pasado, también hay diferencias: dos medicamentos huérfanos menos financiados, seis entre enero y agosto de 2022 -dos en el primer cuatrimestre y cuatro en el segundo- frente a ocho del mismo periodo de 2021 -dos en el primer cuatrimestre y seis en el segundo-.
Revalmed, ¿solución para enfermedades raras?
Aelmhu dice ser consciente de que este es un asunto que también preocupa al Ministerio de Sanidad "y, por eso, mantenemos nuestra disposición para trabajar conjuntamente en diferentes vías de solución".
¿Cuál sería, entonces, la solución? La red de evaluación de medicamentos, denominada REvalMed SNS, dedica uno de sus siete nodos formado por expertos a enfermedades raras... "Más allá de los nodos, la cuestión es que en países de nuestro entorno se da un acceso prioritario a este tipo de medicamentos, mientras que en España se trata a todos los productos y enfermedades por igual, basando la financiación en la mayoría de los casos solo en criterios de coste y eficiencia".
Por ello inciden en que "las enfermedades específicas que tratan los medicamentos huérfanos requieren de un abordaje diferente al habitual: más ágil y con criterios de evaluación propios".
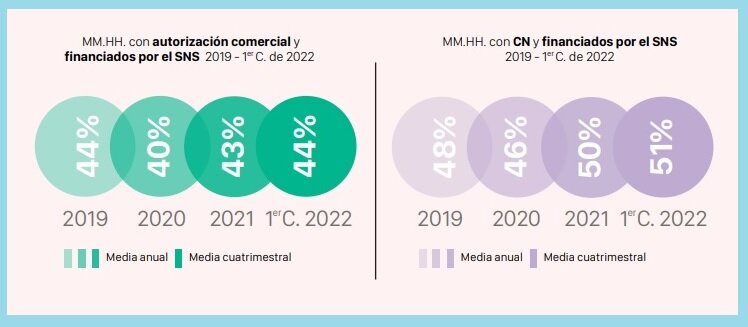
Con 2022 a punto de finalizar, Aelmhu matiza que están recabando los últimos datos que se están produciendo en este último cuatrimestre del año. ¿El objetivo? "Valorar, en conjunto, la tendencia del Ministerio y sacar conclusiones sobre la situación de las terapias huérfanas este año, que haremos públicas en nuestro Informe Anual".
Aun así, con los datos disponibles en la mano, ya han extraído algunas conclusiones:
-"La primera es que en lo que llevamos de ejercicio han llegado a España un 85% de los medicamentos huérfanos autorizados en la UE, pero solo está financiado un 43% de los mismos".
-Además, "el 47% de los productos que han sido financiados lo han hecho con restricciones; es decir, con limitación de indicaciones o con indicaciones no financiadas".
-"Finalmente, cabe recordar que un medicamentos huérfano espera, de media, para lograr una decisión de precio y reembolso, 26 meses (estos son más de 2 años)".
No obstante, sí creen que "la pandemia de la covid19 ha puesto sobre la mesa la importancia de la salud y el impacto que la innovación farmacéutica tiene en la vida diaria de las personas, una relevancia que en el caso los cerca de 3 millones de pacientes y familias que conviven con una enfermedad rara en nuestro país era, es y seguirá siendo, a todos los efectos, su única esperanza".
via Noticias de diariomedico.... https://ift.tt/arOzlEF


No hay comentarios:
Publicar un comentario