Todos entendimos la importancia del contacto cuando no pudimos tenerlo en el confinamiento y gran parte de la pandemia por covid. Imaginemos que ese aislamiento se iniciara desde que nacemos y solo pudiéramos tener contacto con los demás a través de un plástico. Es la historia de David Vetter, un niño que nació en 1971 en Estados Unidos con inmunodeficiencia combinada grave (IDCG o SCID, por sus siglas en inglés), una enfermedad hereditaria poco frecuente (en torno a un caso por cada 35.000-50.000 nacimientos) que provoca anomalías en las funciones de los linfocitos T y en los linfocitos B.
Hay varios tipos de IDCG, en algunos está ligada al cromosoma X (la forma que tenía Vetter) y en otros se debe a mutaciones en un gen que les impide producir determinadas proteínas vitales en la formación, funcionamiento u organización de los linfocitos (por ejemplo, la adenosina desaminasa). Por eso, las personas con IDCG no tienen defensas frente a los patógenos, su sistema inmune no puede hacer frente a infecciones, por lo que es difícil que puedan pasar del año de vida.
Conscientes de eso, los médicos prepararon una cámara especial, una especie de burbuja de plástico con aire esterilizado (de ahí que a la enfermedad se la conozca también como el Síndrome del niño burbuja) donde metieron a Vetter en cuanto nació, sin pasar por los brazos de su madre. Toda su vida se reducía a esa burbuja, comía, jugaba, dormía dentro de ese pequeño mundo, que se concibió como algo pasajero mientras encontraban un donante compatible de médula ósea o una cura para la enfermedad. Hasta la NASA creó un traje especial para que el niño pudiera salir al exterior permaneciendo aislado. Pero Vetter no salió de su burbuja hasta casi el final de su vida, a los 12 años.
Tratamiento actual
Hasta ahora el tratamiento para esta enfermedad era el trasplante de médula ósea (o de sangre cordón umbilical), teniendo más posibilidades de funcionar si se realiza en los tres primeros meses de vida (por eso es tan importante el cribado neonatal o prueba del talón, para diagnosticarlo desde el principio y no esperar a que el niño tenga infecciones y se deteriore). El donante ideal es un hermano o hermana del paciente. Pero dos tercios de los afectados no encuentran donantes completamente compatibles y en torno a un tercio de los niños con IDCG desarrolla problemas inmunitarios años después del trasplante.
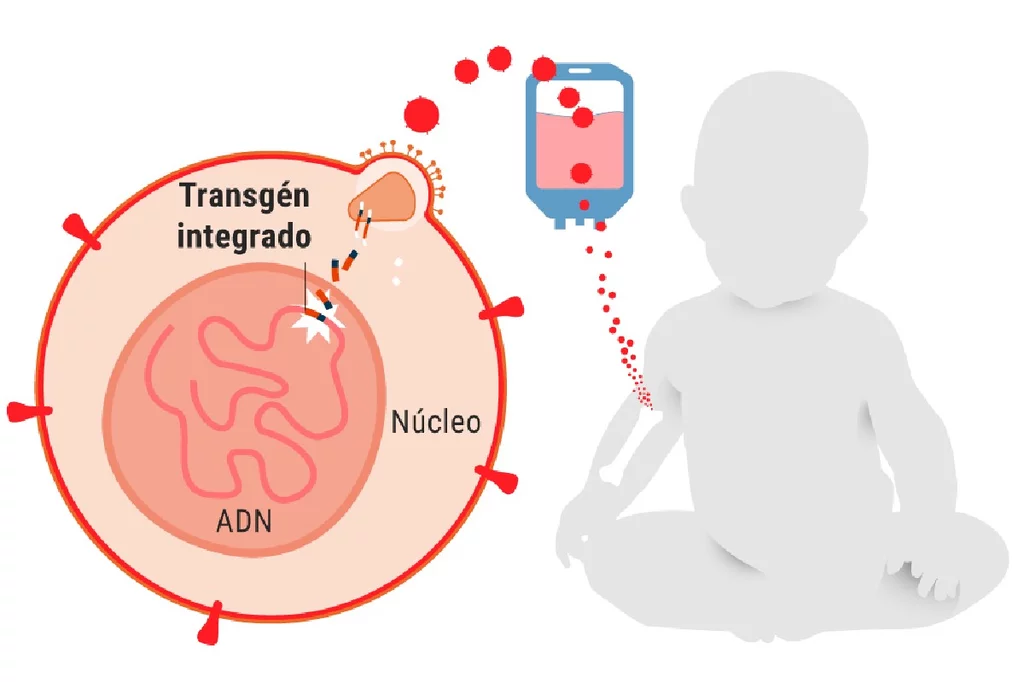
La terapia génica se ha convertido en la gran esperanza para que estos niños puedan salir de esa burbuja. En los últimos años se vienen desarrollando varios estudios de esta técnica aplicada a niños con IDCG que están dando sus frutos. Es el caso del trabajo publicado este miércoles por The New England Journal of Medicine, realizado por un equipo liderado por Morton J. Cowan, director médico del Laboratorio de Terapia Celular Pediátrica de la Universidad de California, en San Francisco, y experto en estas inmunideficiencias combinadas graves.
Este trabajo en fase I-II (Terapia génica lentiviral para SCID con deficiencia de Artemisa) se centra en la IDCG con deficiencia de Artemisa, una enzima esencial para el desarrollo y función de los linfocitos T y B cuyo déficit se debe a mutaciones en el gen DCLRE1C. Este tipo de IDCG responde mal al trasplante de médula ósea de un donante (trasplante alogénico de células hematopoyéticas) y es más difícil de tratar por otras complicaciones asociadas, ya que Artemisa es clave en la reparación del daño del ADN de doble cadena.
via Noticias de diariomedico.... https://ift.tt/r1hOnaX


No hay comentarios:
Publicar un comentario